| Содержание углерода в горючем веществе, w (С) % | Содержание кислорода в горючем веществе, w (О) % | Характер свечения пламени |
| < 50 | > 30 | пламя бесцветное или голубоватое |
| < 75 | отсутствует или < 30 | пламя яркое, не коптящее |
| > 75 | отсутствует или < 25 | пламя яркое, коптящее |
Решение:
1. Массовые доли углерода и кислорода в молекуле метаналя составляют:
Мr (НСОН) = 30
w (С) = 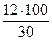 = 40 %; w (О) =
= 40 %; w (О) = 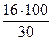 = 53 %
= 53 %
Массовая доля углерода < 50 %, а массовая доля кислорода > 30 %, следовательно, при горении метаналя наблюдается голубоватое пламя.
2. Массовые доли углерода и кислорода в молекуле фенола составляют:
Мr (С6Н5ОН) = 94
w (С) = 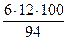 = 77 %; w (О) =
= 77 %; w (О) = 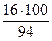 = 17 %
= 17 %
Массовая доля углерода > 50 %, а массовая доля кислорода < 25 %, следовательно, пламя при горении фенола яркое и коптящее.
3. Массовые доли углерода и кислорода в молекуле пентанола составляют:
Мr (С5Н11ОН) = 88
w (С) = 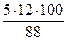 = 68 %; w (О) =
= 68 %; w (О) = 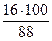 = 18 %
= 18 %
Массовая доля углерода < 75 %, а массовая доля кислорода < 30 %, следовательно, пламя при горении пентанола будет ярким, но не коптящим.
| 2.2. Расчет низшей теплоты сгорания | Пример. Вычислить низшую теплоту сгорания сульфадимезина С12Н14О2N4S по формуле Д.И. Менделеева. |
Значения низшей теплоты сгорания веществ и материалов приведены в справочниках, а также могут быть рассчитаны по формуле Д.И.Менделеева.
|
|
|
| QН = 339,4 [C] + 1257 [H] - 108,9 { ([O] + [N]) - [S] } - 25,1 (9 [H] + [W]), кДж/кг, где [C], [H], [O], [N], [S], [W] - содержание (в процентах) углерода, водорода, кислорода, азота, серы и влаги в горючем веществе. Данная формула может быть использована для расчетов Qн веществ сложного элементного состава, а также для любых индивидуальных веществ. |
Решение:
1. Для того, чтобы воспользоваться данной формулой, необходим расчет процентного состава каждого элемента в веществе.
Молярная масса сульфадимезина С12Н14О2N4S составляет 278 г/моль.
[C] = 144/278 = 0,518 ×100 = 51,8 %
[H] = 14/278 = 0,05 ×100 = 5,0 %
[O] = 32/278 = 0,115 ×100 = 11,5 %
[N] = 56/278 = 0,202 ×100 = 20,2 %
[S] = 100 – (51,8 + 5,0 + 11,5 + 20,2) = 11,5 %
2. Подставляем найденные значения в формулу Д.И. Менделеева.
QН = 339,4×51,8+1257×5,0-108,9×(11,5+20,2-11,5)-25,1×9×5,0=
= 22741 кДж/кг = 22,7 МДж/кг.
| 2.3. Составление уравнений реакций горения в кислороде и в воздухе | Пример. Составить уравнение реакции горения в кислороде пропана С3Н8 и глицерина С3Н8О3; уравнение реакции горения водорода Н2 и пропанола С3Н7ОН в воздухе. |
Составляя уравнение реакции горения, следует помнить, что в пожарно-технических расчетах принято все величины относить к 1 молю горючего вещества. Это, в частности, означает, что в уравнении реакции горения перед горючим веществом коэффициент всегда равен 1.
Состав продуктов горения зависит от состава исходного вещества.
|
|
|
| Элементы, входящие в состав горючего вещества | Продукты горения |
| Углерод С | Углекислый газ СО2 |
| Водород Н | Вода Н2О |
| Сера S | Оксид серы (IV) SO2 |
| Азот N | Молекулярный азот N2 |
| Фосфор Р | Оксид фосфора (V) Р2О5 |
| Галогены F, Cl, Br, I | Галогеноводороды HCl, HF, HBr, HI |
 2015-10-13
2015-10-13 577
577








