По закону Рауля понижение температуры кристаллизации и повышение температуры кипения раствора (Δt) по сравнению с температурами кристаллизации и кипения растворителя выражаются уравнением: 
Δt = K·Cm(А), (1)
где К – криоскопическая или эбуллиоскопическая константа; для воды они соответственно равны 1,860 и 0,520; Сm(А) – моляльная концентрация растворенного вещества А, которая рассчитывается по формуле:
Сm(А) = 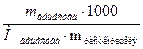 . (2)
. (2)
Понижение температуры кристаллизации 2%-ного раствора С6Н12О6 находим из формулы (1):
Δtзам. р-ра = 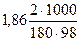 = 0,210.
= 0,210.
Вода кристаллизуется при 0оС, следовательно, температура кристаллизации раствора
tзам. р-ра = 0 – 0,21 = - 0,21оС.
Из формулы (1) повышение температуры кипения 2 %-ного раствора С6Н12О6 равно
Δtкип. р-ра = 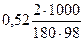 = 0,06о.
= 0,06о.
Вода кипит при 100оС, следовательно, температура кипения этого раствора
tкип. р-ра = 100 + 0,06 = 100,06оС.
Пример 2. Раствор, содержащий 1,22 г бензойной кислоты С6Н5СООН в 100 г сероуглерода, кипит при 46,529о С. Температура кипения сероуглерода 46,3о С. Вычислить эбуллиоскопическую константу сероуглерода.
 2015-10-14
2015-10-14 251
251







