| Кислородсодержащие | Бескислородные |
| 1. Изменяют окраску индикатора | |
| лакмус – красный, метилоранж – розовый | |
| 2. Взаимодействие с металлами, стоящими в электрохимическом ряду напряжений до водорода (кроме концентрированной серной кислоты, азотной кислоты любой концентрации) | |

| 
|
| 3. Взаимодействие с основными оксидами | |

| 
|
| 4. Взаимодействие с основаниями | |

| 
|
| 5. Взаимодействие с амфотерными оксидами | |

| 
|
| 6. Взаимодействие с солями, если образуется малорастворимое, летучее или малодиссоциирующее вещество | |

| 
|
| 7. Разложение при нагревании | |
Слабые кислоты легко разлагаются

| 
|
Кислоты классифицируют по нескольким признакам:
1) по составу кислотного остатка – кислородсодержащие ( ) и бескислородные (
) и бескислородные ( );
);
2) основности (количеству атомов водорода, способных замещаться атомами металла) – одноосновные ( ) двухосновные (
) двухосновные ( ), трехосновные (
), трехосновные ( ).
).
3) силе электролита – сильные ( ), средней силы (
), средней силы (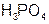 ), слабые (
), слабые ( ).
).
Основные гидроксиды (основания) –соединения атомов металла с гидроксогруппами. Общая формула оснований: Me(OH)n, где n – кислотность основания. Получение и свойства оснований показаны в табл. 4, 5.
|
|
|
Таблица 4
Получение оснований
| Щелочи | 1. Металл+вода | 

|
| 2. Оксид+вода | 

| |
| 3. Электролиз растворов щелочных металлов | 
| |
| Нерастворимые основания | Соль+щелочь | 
|
Таблица 5
Химические свойства оснований
| Щёлочи | Нерастворимые основания |
| 1. Взаимодействие с кислотами | |

| 
|
| 2. Взаимодействие с кислотными оксидами | |

| не характерны |
| 3. Действие индикаторов | |
| лакмус становится синим, фенолфталеин – малиновым, метиловый оранжевый – желтым | окраска не изменяется |
| 4. Взаимодействие с амфотерными оксидами | |

| не реагируют |
| 5. Взаимодействие с солями, если образуется малорастворимая соль или малорастворимое основание | |

| не реагируют |
| 6. При нагревании | |
| не разлагаются (кроме LiOH) | 
|
| Амфотерные гидроксиды Al(OH)3, Zn(OH)2, Be(OH)2 и другие | |
Взаимодействуют с кислотами


| Взаимодействуют сo щелочами


|
Основания классифицируют:
1) по числу гидроксогрупп – однокислотные ( и т. д. ) и многокислотные (
и т. д. ) и многокислотные ( и т. д.);
и т. д.);
2) растворимости в воде – растворимые (щелочи), гидроксиды щелочных и щелочноземельных металлов ( ) и нерастворимые (
) и нерастворимые ( ).
).
3) химическому характеру взаимодействия с кислотами и основаниями – типичные (основания) и амфотерные (гидроксиды), которые при взаимодействии с кислотами выступают как основания, а со щёлочью – как кислоты ( ).
).
Соли – это сложные вещества, состоящие из атомов металлов и кислотных остатков.
При полном замещении ионов водорода в молекуле кислоты на ионы металла образуются средние (нормальные) соли. Общая формула Mex(ЭOy)n. Получение и свойства показаны в табл. 6, 7.
|
|
|
Таблица 6
Получение солей
| 1. С использованием металлов | Средние (нормальные) соли | |
| металл+неметалл | 
| |
металл (стоящий до Н)+
+кислота (кроме  ) )
| 
| |
| металл (более активный, чем металл в соли)+соль | 
| |
| 2. С использованием оксидов | основной оксид+кислота | 
|
| кислотный оксид+основание | 
| |
| кислотный+основной оксиды | 
| |
| основной+амфотерный оксиды | 
| |
| 3. Реакция нейтрализации | кислота+основание | 
|
| 4. Из солей | соль+соль | 
|
| соль+щелочь | 
| |
| соль+кислота | 
| |
| Кислые соли получают такими же способами, что и средние, но при других мольных соотношениях (при избытке кислоты) | ||

| ||
| Основные соли образуются при взаимодействии солей со щелочами (при избытке щелочи) | ||

|
Таблица 7
 2015-10-22
2015-10-22 1261
1261







