Раздел химии, изучающий тепловой эффект реакции называется химической термодинамикой. В химических уравнениях, в которых указана теплота реакции и агрегатные состояния веществ, называются термохимическими.
Тепловой эффект – это количество теплоты Q, которое выделяется или поглощается при получении 1 моля сложного вещества из простых веществ.
Объектом изучения химической термодинамики является система.
Система – это изучаемое тело или группа тел, которые взаимодействуют между собой и мысленно или реально отделены от окружающей среды границами, проводящими или не проводящими тепло.
В зависимости от характера взаимодействия системы с окружающей средой различают открытые, закрытые и изолированные системы.
Открытые системы могут обмениваться с окружающей средой энергией и веществом. Например, водный раствор хлорида натрия, находящийся в открытом сосуде. При испарении воды из раствора и при теплообмене будут меняться масса системы и ее температура, а, следовательно, и энергия.
|
|
|
Закрытые системы не обмениваются с окружающей средой веществом. Например, раствор хлорида натрия в закрытом сосуде. Если раствор и окружающая среда имеют разную температуру, то будет происходить нагревание или охлаждение раствора, а, следовательно, будет меняться его энергия.
Изолированные системы не могут обмениваться со средой ни веществом, ни энергией. Изолированная система – это идеализация. В природе таких систем нет. Но, несмотря на невозможность практического воплощения, изолированные системы позволяют определять максимальные теоретические разности энергий между системой и ее окружением.
Состояние системы определяется совокупностью свойств и характеризуется термодинамическими параметрами: температурой  , давлением
, давлением  , объемом
, объемом 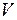 , плотностью
, плотностью  , количеством вещества
, количеством вещества 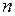 , совершаемой работой
, совершаемой работой  , теплотой
, теплотой  . Изменение хотя бы одного термодинамического параметра приводит к изменению состояния системы в целом. Если все параметры постоянны во времени и пространстве, то такое состояние системы называется равновесным.
. Изменение хотя бы одного термодинамического параметра приводит к изменению состояния системы в целом. Если все параметры постоянны во времени и пространстве, то такое состояние системы называется равновесным.
В термодинамике свойства системы рассматриваются в ее равновесных состояниях: начальных и конечных, вне зависимости от пути перехода системы из одного состояния в другое. Переход системы из одного состояния в другое при  ,
,  = const называется изобарно-изотермическим, при
= const называется изобарно-изотермическим, при 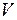 ,
,  = const – изохорно-изотермическим.
= const – изохорно-изотермическим.
Важнейшими задачами химической термодинамики является выяснение возможности или невозможности самопроизвольного протекания процесса той или иной химической реакции при заданных условиях и в заданном направлении; установление значения термодинамических параметров, при которых достигается максимальный выход процесса; определение характеристик энергетического изменения, происходящего в системе. Находят это с помощью термодинамических функций ( ).
).
|
|
|
Функция состояния  характеризует внутреннюю энергию системы – сумму потенциальной энергии взаимодействия всех частиц тела между собой и кинетической энергии их движения. Она зависит от состояния вещества – вида, массы, агрегатного состояния. Абсолютную величину внутренней энергии измерить невозможно, поэтому при изучении химических процессов судят об изменении внутренней энергии при переходе системы из одного состояния в другое.
характеризует внутреннюю энергию системы – сумму потенциальной энергии взаимодействия всех частиц тела между собой и кинетической энергии их движения. Она зависит от состояния вещества – вида, массы, агрегатного состояния. Абсолютную величину внутренней энергии измерить невозможно, поэтому при изучении химических процессов судят об изменении внутренней энергии при переходе системы из одного состояния в другое.
 . (11)
. (11)
При этом  внутренняя энергия системы убывает, при
внутренняя энергия системы убывает, при  – возрастает.
– возрастает.
Все изменения внутренней энергии происходят за счет хаотического столкновения молекул (мерой передаваемой таким способом энергии является теплота) и перемещения масс, состоящих из большого числа частиц, под действием каких-либо сил (мерой передаваемой таким способом энергии является работа). Таким образом передача внутренней энергии может осуществляться частично в виде теплоты и частично в виде работы:
 . (12)
. (12)
Приведенное уравнение представляет собой математическое выражение I закона термодинамики: если к системе подвести тепло, то подведенное тепло тратится на увеличение внутренней энергии системы и на совершение ею работы.
В изохорном процессе вся теплота, подведенная к системе, тратится на изменение внутренней энергии:
 . (13)
. (13)
В изобарном процессе единственным видом работы, совершаемой системой, является работа расширения:
 , (14)
, (14)
где  – давление в системе;
– давление в системе;  – изменение объема
– изменение объема
Тогда математическое выражение I закона термодинамики принимает вид:
 . (15)
. (15)
Обозначив  , где Н – энтальпия (от греч. enthalpo нагреваю) – мера энергии, накапливаемой веществом при его образовании, получаем:
, где Н – энтальпия (от греч. enthalpo нагреваю) – мера энергии, накапливаемой веществом при его образовании, получаем:  ,
,  .
.
Функция состояния системы Н – это общий запас энергии системы,
т. е. это энергосодержание системы. Энтальпия системы больше внутренней энергии на величину работы. Абсолютное значение нельзя измерить, поэтому судят об энтальпии при переходе системы из одного состояния в другое.
Если реакция эндотермическая (протекает с поглощением тепла), то  . Если реакция экзотермическая (протекает с выделением тепла), то
. Если реакция экзотермическая (протекает с выделением тепла), то  .
.
Для сравнения тепловых эффектов различных процессов стандартизуют условия их протекания.
Стандартные условия – Т0 = 298 К, р0 = 101,313 кПа, n – 1 моль чистого веществ. Все стандартные термодинамические функции – это справочные величины, которые зависят от природы вещества, агрегатного состояния вещества.
Стандартное изменение энтальпии ( ) относят к единице количества вещества, кДж/моль.
) относят к единице количества вещества, кДж/моль.
Из I закона термодинамики следуют количественные законы термохимии.
Закон Лавуазье-Лапласа (1780–1784) – для каждого химического соединения теплота разложения равна теплоте его образования, но имеет противоположный знак.
 . (16)
. (16)
Закон Г.И. Гесса (1840) – тепловой эффект химической реакции зависит от природы и физического состояния исходных веществ и конечных продуктов, но не зависит от характера и пути протекания реакции.
Данный закон – теоретическая основа термохимии. Из него вытекает ряд следствий:
● количество энергии, которое выделяется или поглощается при образовании 1 моля сложного вещества из простых в стандартных условиях, называется стандартной энтальпией образования ( , кДж/моль);
, кДж/моль);
● в термохимических расчетах теплота образования (энтальпия) простых веществ в стандартных условиях принимается равной нулю
 ;
;
● количество энергии, которое выделяется или поглощается 1 молем органического вещества разлагающегося до углекислого газа и воды в стандартных условиях, называется стандартной энтальпией сгорания ( , кДж/моль);
, кДж/моль);
|
|
|
● энтальпия химической реакции равна разности между суммой энтпльпии образования продуктов реакции и суммой энтальпии образования исходных веществ с учетом стехиометрических коэффициентов энтальпий:
 , (17)
, (17)
где  – энтальпия химической реакции в стандартных условиях;
– энтальпия химической реакции в стандартных условиях;  – сумма стандартных энтальпий образования продуктов реакции;
– сумма стандартных энтальпий образования продуктов реакции;  – сумма стандартных энтальпий образования исходных веществ;
– сумма стандартных энтальпий образования исходных веществ;  ,
,  – стехиометрические коэффициенты соответственно продуктов реакции и исходных веществ.
– стехиометрические коэффициенты соответственно продуктов реакции и исходных веществ.
Закон Гесса позволяет рассчитать тепловые эффекты (энтальпии) различных реакций. Но знак и величина теплового эффекта не позволяет судить о способности процессов к самопроизвольному протеканию и не содержит информации о направлении и полноте протекания процессов.
Самопроизвольные процессы (естественные или положительные) протекают в системе без вмешательства со стороны внешней среды и сопровождаются уменьшением внутренней энергии системы и передачей энергии в окружающую среду в форме теплоты и работы. Эндотермические самопроизвольные процессы не противоречат этому определению, так как они могут протекать в неизолированной системе и производить работу за счет теплоты окружающей среды.
Процессы, которые сами собой (без внешнего воздействия) совершаться не могут, называются несамопроизвольными, неестественными или отрицательными. Такие процессы осуществляются путем передачи системе энергии из внешней среды в форме теплоты или работы.
Согласно I закону термодинамики самопроизвольные процессы идут в сторону уменьшения запаса внутренней энергии или энтальпии системы.
Однако известны такие процессы, которые протекают самопроизвольно без изменения внутренней энергии системы. Движущей силой таких процессов является энтропия системы.
Энтропия (связанная энергия) S – это мера необратимости процесса, мера перехода энергии в такую форму, из которой она не может самостоятельно перейти в другую энергию. Энтропия характеризует беспорядок в системе, чем выше беспорядок, тем выше энтропия.
|
|
|
Энтропия вещества в стандартном состоянии называется стандартной энтропией  [Дж/моль × К].
[Дж/моль × К].
В изолированных системах самопроизвольно протекают процессы в направлении увеличения энтропии ( ), что является II законом термодинамики.
), что является II законом термодинамики.
Процессы, для которых энтропия уменьшается ( ) неосуществимы в изолированных системах.
) неосуществимы в изолированных системах.
Энтропия простых веществ не равна нулю. В отличие от энтальпии можно измерить абсолютное значение энтропии. «При абсолютном нуле энтропия идеального кристалла равна нулю» – этот постулат М. Планка (1911) называют III законом термодинамики.
Изменение энтропии химического процесса определяется балансовым уравнением:
 . (18)
. (18)
Любая система характеризуется энтальпией (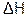 ) и энтропией (
) и энтропией ( ). Их соотношение определяет направление протекания реакции.
). Их соотношение определяет направление протекания реакции.
Таким образом, при самопроизвольном движении системы к устойчивому состоянию проявляются две тенденции: уменьшение энтальпии  и возрастание энтропии
и возрастание энтропии  . Суммарный эффект двух тенденций при постоянных температуре и давлении отражает энергия Гиббса
. Суммарный эффект двух тенденций при постоянных температуре и давлении отражает энергия Гиббса  , которая рассчитывается по уравнению
, которая рассчитывается по уравнению
 , (19)
, (19)
называемому уравнением Гиббса.
Функция состояния  характеризует общую движущую силу процесса, максимально возможную полезную работу («свободная энергия»), совершаемую системой
характеризует общую движущую силу процесса, максимально возможную полезную работу («свободная энергия»), совершаемую системой 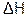 ;
;  – часть энергии, которая не может быть превращена в полезную работу («связанная энергия»).
– часть энергии, которая не может быть превращена в полезную работу («связанная энергия»).
Если исходные вещества и продукты реакции находятся в стандартных состояниях, то изменение энергии Гиббса называется изменением стандартной энергии Гиббса химической реакции  [кДж/моль].
[кДж/моль].
Химические реакции протекают в открытом сосуде с изменением объема, поэтому возможность (самопроизвольность) и направление процесса характеризует функция  , определяемая по балансовому уравнению при стандартных условиях:
, определяемая по балансовому уравнению при стандартных условиях:
 . (20)
. (20)
Самопроизвольному протеканию процесса отвечает уменьшение энергии Гиббса,  . Чем больше уменьшается
. Чем больше уменьшается  , тем более необратимо протекает процесс в сторону образования продуктов реакции.
, тем более необратимо протекает процесс в сторону образования продуктов реакции.
Увеличение изобарного потенциала  является признаком неосуществимости процесса в данных условиях.
является признаком неосуществимости процесса в данных условиях.
Значение  характеризует состояние равновесия, т. е. состояние, в котором система не производит полезной работы.
характеризует состояние равновесия, т. е. состояние, в котором система не производит полезной работы.
Анализ величин 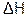 и
и  в уравнении Гиббса показал, что возможность обратимого протекания процесса обусловлена одинаковыми знаками
в уравнении Гиббса показал, что возможность обратимого протекания процесса обусловлена одинаковыми знаками 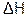 и
и  . При определенной температуре величины
. При определенной температуре величины 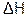 и
и  становятся равными. Поэтому из уравнения Гиббса можно определить «равновесную» температуру или температуру начала процесса
становятся равными. Поэтому из уравнения Гиббса можно определить «равновесную» температуру или температуру начала процесса  при
при  ;
;
 . (21)
. (21)
Таким образом, самопроизвольно протекают реакции, в которых изменение свободной энергии отрицательно. Реакции, в которых  , протекают лишь при условии, что над системой будет совершена работа внешними силами или системе будет передана энергия извне.
, протекают лишь при условии, что над системой будет совершена работа внешними силами или системе будет передана энергия извне.
 2015-10-22
2015-10-22 1882
1882








