Титриметричний аналіз ґрунтується на вимірюванні об’єму розчину реагенту (титранту) точно відомої концентрації, витраченого на реакцію з визначуваним іоном (речовиною).
За типом хімічної реакції методи титриметричного аналізу поділяються:
1) кислотно-основне титрування (протолітометрія);
2) окисно-відновне титрування (редоксиметрія);
3) осаджувальне титрування (седиметрія);
4) комплексометричне титрування (комплексометрія).
В основу розрахунків у титриметричному аналізі покладений закон еквівалентів.
Поняття еквівалентності реагуючих речовин у хімічних реакціях було і залишається одним з основних понять у хімії, у тому числі й в аналітичній.
Еквівалентом (f екв.(X) X) називається деяка реальна чи умовна частка, що може приєднувати, вивільняти або бути яким-небудь іншим чином еквівалентною одному іону Гідрогену в кислотно-основних реакціях або одному електрону в окисно-відновних реакціях.
Еквівалентність. Запишемо в загальному вигляді рівняння
a + b → продукти реакції
Припустимо, що а > b, тоді одна умовна частка речовини А буде еквівалентна b/а умовної частки речовини В у даній реакції.
Відношення b/a є фактор еквівалентності речовини та позначається f екв.(B).
Наприклад, у реакції
2NaOH + H2SO4 → Na2SO4 + 2H2O
f екв.(H2SO4) = 1/2, а еквівалент сульфатної кислоти f екв.(H2SO4) H2SO4 дорівнює 1/2 М (H2SO4).
У реакції
NaOH + H3PO4 → Na2PO4 + H2O
еквівалент фосфорної кислоти f екв.(H3PO4) H3PO4 дорівнює M (H3PO4), а в реакції
3NaOH + H3PO4 → Na3PO4 + H2O
– 1/3 M (H3PO4).
В окисно-відновній реакції фактор еквівалентності й еквівалент розраховують, виходячи із кількості прийнятих чи відданих електронів. Так, для K2Cr2O7 еквівалент дорівнюватиме 1/6 M(K2Cr2O7) відповідно до реакції
K2Cr2O7 +6ē + 14H+ → 2K+ + 2Cr3+ + 7H2O
З огляду на те, що кількість реагуючих речовин еквівалентна,
n (NаО) = n (1/2 H2SO4),
де n – число молів еквівалентів.
Маса моля еквівалента називається молярною масою еквівалента. Наприклад, маса одного моля 1/2 H2SO4 становить 49 г у реакції з лугом, а маса одного моля 1/5 KMnО4 – 31,6 г у процесі окисно-відновних реакцій у кислому середовищі.
Молярна концентрація еквівалента – відношення числа молів еквівалентів розчиненої речовини до об’єму розчина; одиницею виміру є моль-екв/дм3. Для позначення молярної концентрації еквівалента можна використовувати, наприклад, такі форми запису: С(1/2 H2SO4) = 0,1000 М, або 0,1000 М (1/2 H2SO4); С(1/5 KMnО4) = 0,0500 М, або 0,0500 М (1/5 KMnО4).
Відношення молярної концентрації до молярної концентрації еквівалента дорівнює фактору еквівалентності (f екв.(А)). Якщо фактор еквівалентності дорівнює 1, то використання молярної концентрації еквівалента втрачає смисл. У цьому випадку доцільніше використовувати молярну концентрацію.
Стандартний розчин – це розчин із точно відомою концентрацією хімічно активної речовини або з точно відомим титром.
Титр – Т (А) – показує, яка маса речовини А (у грамах) міститься в 1 см3 її розчину. Зв'язок титру з молярною концентрацією еквівалента можна виразити в такий спосіб:
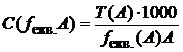 . (2)
. (2)
Аналогічно для молярної концентрації
 . (3)
. (3)
Для розрахунку маси обумовленої речовини в серійних аналізах застосовують такий спосіб вираження концентрації, як титр речовини А за визначуваною речовиною Х.
Титр за визначуваною речовиною Т (А/Х) (г/см3) – це відношення маси m (Х) визначуваної речовини до еквівалентного об’єму V (А) робочого розчину:
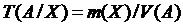 . (4)
. (4)
Таким чином, Т (А/Х) показує, яка маса аналізованої речовини реагує з 1см3 робочого розчину А (або еквівалентна йому). Знаючи Т (А/Х) (г/см3) та об’єм (см3) робочого розчину V (А), витраченого на титрування, розраховують масу (г) визначуваної речовини:
 . (5)
. (5)
Для переходу від Т (А/Х) до молярної концентрації еквівалента або навпаки необхідно застосувати формулу
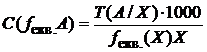 . (6)
. (6)
Розрахунки в титриметрії ґрунтуються на еквівалентності реагуючих речовин, отже,
 , (7)
, (7)
де СR, CX – молярні концентрації еквівалента титранту й аналізованого розчину; VR, V X – об’єми цих розчинів відповідно.
Під час знаходження маси визначуваної речовини за відомими нормальною концентрацією та об’ємом титранту зручніше застосовувати формулу
 (8)
(8)
або аналогічне рівняння
 (9)
(9)
у разі, коли доцільне застосування молярної концентрації (якщо f екв.(Х) = 1).
 2017-12-14
2017-12-14 1137
1137








