1. Ковалентная хим связь образуется двумя электронами с противоположно направленными спинами, принадлежащими двум атомам.
2. Ков. связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
3. Характеристики химической связи определяются типом перекрывания АО.
4. Ковалентная связь направлена в сторону максимального перекрывания АО реагирующих атомов.
Образование молекулы водорода можно представить следующим образом: (рис.4)
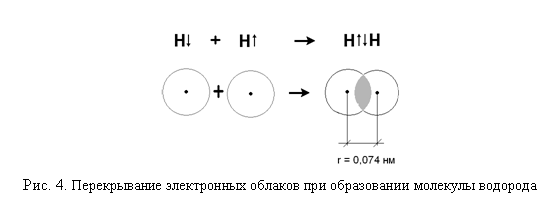
Ковалентной связью называется связывание атомов с помощью общих электронных пар.
Рассмотрим связывание двух атомов хлора 17Cl (заряд ядра Z = 17) в двухатомную молекулу с позиций строения электронных оболочек хлора. Для этого запишем формулу Льюиса для атома хлора и конфигурацию его внешней электронной оболочки:

На внешнем электронном уровне хлора содержится s2 + p5 = 7 электронов. Электроны нижних уровней не принимают участия в хим взаимодействии, точками мы обозначили только электроны внешнего, третьего уровня. Внешние электроны можно расположить в виде 3 электронных пар и одного неспаренного электрона.
|
|
|
После объединения атомов в молекулу из двух неспаренных электронов атомов получается новая электронная пара:
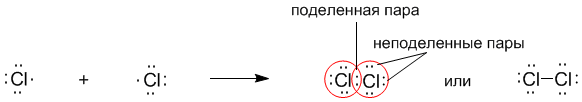
При этом каждый из атомов хлора оказывается в окружении ОКТЕТА электронов. В этом легко убедиться, если обвести кружком любой из атомов хлора.
Ковалентную связь образует только пара электронов, находящаяся между атомами. Она называется поделенной парой. Остальные пары электронов называют не поделенными парами. Они заполняют оболочки и не принимают участие в связывании.
Льюис не только предложил теорию ковалентной связи, но и первым сформулировал правило октета-дублета. Это правило применительно к хим связям можно сформулировать так: атомы образуют связи в результате обобществления такого кол-ва электронов, чтобы приобрести электронную конфигурацию, подобную завершенной электронной конфигурации атомов благородных элементов.
Два атома водорода, объединившись в молекулу, приобрели “завершенную” молекулярную оболочку, подобную завершенной электронной оболочке атома благородного газа гелия (1s2). Атомы хлора в молекуле приобрели молекулярную оболочку, похожую на завершенную оболочку атома аргона (...3s23p6).
Познакомимся теперь с ионной связью. Движущей силой ее образования является все то же стремление атомов к октетной оболочке. Но в ряде случаев такая “октетная” оболочка может возникнуть только при передаче электронов от одного атома к другому. Поэтому ионная связь возникает только между атомами разного вида.
Рассмотрим конкретный пример: реакцию между атомами натрия (Z = 11) и фтора (Z = 9). При образовании связи между ними оба элемента приобретают внешнюю электронную оболочку благородного газа неона (Z = 10). Для того, чтобы убедиться в этом, надо записать электронные формулы всех трех элементов:
|
|
|
Na: 1s2 2s2 2p6 3s1
F: 1s2 2s2 2p5
Ne: 1s2 2s2 2p6
В электронных формулах нам важны только электронные конфигурации внешних уровней (они подчеркнуты). Запишем реакцию с помощью формул Льюиса:
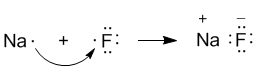
Натрий, отдав фтору свой 3s1-электрон, становится ионом Na+ и остается с заполненной 2s22p6 оболочкой, что отвечает электронной конфигурации атома неона. Такую же электронную конфигурацию приобретает атом F, приняв один электрон, отданный натрием. Теперь это ион F–. Разумеется, при этом ионы F– и Na+ продолжают оставаться все теми же элементами фтором и натрием, потому что никакие электронные переходы не могут число протонов в его ядре.
Теперь в дополнение к ковалентной составляющей хим связи в молекуле Na+: F– добавляется и электростатическое притяжение между ионами натрия и фтора. Это увеличивает прочность связи.
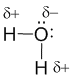
Полярная ковалентная связь занимает промежуточное положение между чисто ковалентной связью и ионной связью. Так же, как и ионная, она может возникнуть между двумя атомами разных видов. В полярной ковалентной связи электроны смещаются от атома к атому не так сильно, как в ионной. Это происходит тогда, когда атомам энергетически невыгодно далеко “отпускать” свои собственные электроны. Если электроны слишком далеко сдвинутся к одному из атомов, молекулярная орбиталь перестанет быть похожей на “октетную”. В качестве примера рассмотрим образование воды в реакции между атомами водорода (Z = 1) и кислорода (Z = 8). Для этого удобно сначала записать электронные формулы для внешних оболочек водорода (1s1) и кислорода (...2s2 2p4). Затем на помощь приходят формулы Льюиса, которые наглядно показывают, как образуются “завершенные” электронные оболочки рядом с атомами водорода и кислорода в молекуле воды:
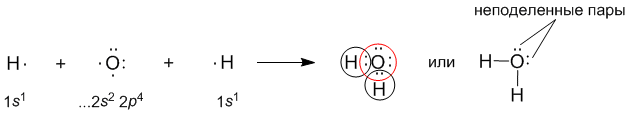
Оказывается, для этого необходимо взять именно два атома водорода на один атом кислорода. Однако природа такова, что акцепторные св-ва атома кислорода выше, чем у атома водорода. Поэтому связывающие электронные пары в формуле Льюиса для воды слегка смещены к ядру атома кислорода. Связь в молекуле воды – полярная ковалентная, а на атомах появляются частичные положительные и отрицательные заряды.
По теории Льюиса и правилу октета связь между атомами может осуществляться не одной, но и двумя и даже тремя поделенными парами, если этого требует правило октета. Такие связи называются двойными и тройными. Например, только что рассмотренный нами кислород может образовывать двухатомную молекулу с октетом электронов у каждого атома только тогда, когда между атомами помещаются две поделенные пары:
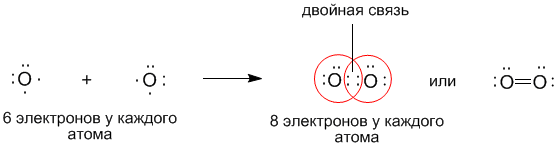
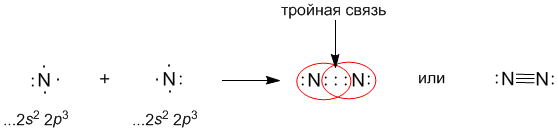
В настоящее время принято изображать электронные пары (химические связи) между атомами черточками. Каждая черточка – это поделенная пара электронов. В этом случае уже знакомые нам молекулы выглядят так:

Формулы с черточками между атомами называются структурными формулами. Чаще в структурных формулах не изображают неподеленные пары электронов, но в ряде случаев (мы столкнемся с ними при обсуждении донорно-акцепторных связей) неподеленные пары играют важную роль.
Структурные формулы очень хороши для изображения молекул: они четко показывают – как атомы связаны между собой, в каком порядке, какими связями.
Два механизма образования:
1.Обменный- общая электронная пара образуется за счет не спаренных электронов в каждой паре.
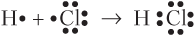
2.Донорно-акцепторный- общая электронная пара образуется за счет готовой не поделенной электронной пары одной части(донор) и свободной орбитали другой части(акцептор).
|
|
|
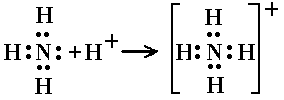
12.Св-ва ковалентной связи. Насыщаемост. Направленность ковалентной связи.
Св-ва ковалентной связи – направленность, насыщаемость, полярность, поляризуемость.
1.Направленность. Чтобы перекрыться максимально электронные облака должны перекрыться относительно друг другу в определенном направлении.
2.Насыщаемость – способность атомов образовывать ограниченное число ковалентных связей. Характерезуется максимальной ковалентностью, т.е максимальное кол-во связей, которые может дать атом.
3.Полярность св обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. Поэтому признаку связи подразделяются на неполярные и полярные.
4.Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Электроны тем подвижнее, чем дальше они находятся от ядер.
Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
 2018-01-21
2018-01-21 1619
1619








