| Степень окисления | Оксид | Гидроксид | Характер | Примечания |
| +2 | FeO | Fe(OH)2 | Слабоосновный | Слабый восстановитель |
| +3 | Fe2O3 | Fe(OH)3 | Очень слабое основание, иногда — амфотерный | Слабый окислитель |
| +6 | Не получен | <H2FeO4>* | Кислотный | Сильный окислитель |
* Кислота в свободном виде не существует — получены только её соли.
Диаграмма Пурбе для Fe-H2O
Для железа характерны степени окисления — +2 и +3.
Степени окисления +2 соответствует чёрный оксид FeO и зелёный гидроксид Fe(OH)2. Они имеют основный характер. В солях Fe(+2) присутствует в виде катиона. Fe(+2) — слабый восстановитель.
Степени окисления +3 соответствуют красно-коричневый оксид Fe2O3 и коричневый гидроксид Fe(OH)3. Они носят амфотерный характер, хотя и кислотные, и основные свойства у них выражены слабо. Так, ионы Fe3+ нацело гидролизуются даже в кислой среде. Fe(OH)3 растворяется (и то не полностью), только в концентрированных щелочах. Fe2O3 реагирует со щелочами только при сплавлении, давая ферриты (формальные соли не существующей в свободном виде кислоты HFeO2):
|
|
|
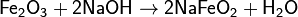
Железо (+3) чаще всего проявляет слабые окислительные свойства.
Степени окисления +2 и +3 легко переходят между собой при изменении окислительно-восстановительных условий.
Кроме того, существует оксид Fe3O4, формальная степень окисления железа в котором +8/3. Однако этот оксид можно также рассматривать как феррит железа (II) Fe+2(Fe+3O2)2.
Также существует степень окисления +6. Соответствующего оксида и гидроксида в свободном виде не существует, но получены соли — ферраты (например, K2FeO4). Железо (+6) находится в них в виде аниона. Ферраты являются сильными окислителями.
Известны также степени окисления −2 (тетракарбонилферрат натрия), −1, 0 (пентакарбонил железа), +1, +4, +5.
 2018-01-21
2018-01-21 940
940