При гибридизации ЧИСЛО ГИБРИДНЫХ ОРБИТАЛЕЙ всегда РАВНО ЧИСЛУ ИСХОДНЫХ АТОМНЫХ ОРБИТАЛЕЙ.
Sp-линейная, sp2-плоская треугольная,sp3-тетраэдрическая,sp2d-квадратная,sp3d-триагональная-бипирамидальная,sp3d2-октаэдрическая
10. Насыщаемость
Максимальнаяковалентность у элементов 2го периода равна 4, т.к. на внешнем энергетическом уровне у них находятся 4 орбитали (s и p) и может разместиться максимум 8 электронов 2s2 2p6 (2+6=8) 8:2=4.
Атомы элементов 3го периода и т.д. имеют и d-орбитали и ковалентность может = 9; 3s23p63d10 (2+6+10=18); 18:2=9.
Способность атомов участвовать в образовании ограниченного числа ковалентных связей называется насыщаемостью.
Направленность
Свойства молекулы, её способность вступать в химическое взаимодействие с другими молекулами (реакционная способность) зависят не только от прочности химических связей в молекуле, но в значительной мере и от её пространственного строения. Этот раздел химии называется стереохимией.
Образование ковалентной связи осуществляется за счет перекрывания электронных облаков взаимодействующих атомов. При этом область перекрывания располагается в определенном направлении к атомам. Иначе говоря обладает направленностью.
Полярность и поляризуемость связи
Если двухатомная молекула состоит из одинаковых атомов, например Н2, Сl2, О2, то молекулярное облако, осуществляющее связь, равномерно, симметрично распределено между ядрами, такая молекула называетсянеполярной, или гомеополярной. Если же связь осуществляется между атомами разных элементов, то молекулярное облако обычно смещается к одному из атомов, возникает асимметрия в распределении зарядов, такая связь и молекула называется полярной, или гетерополярной.
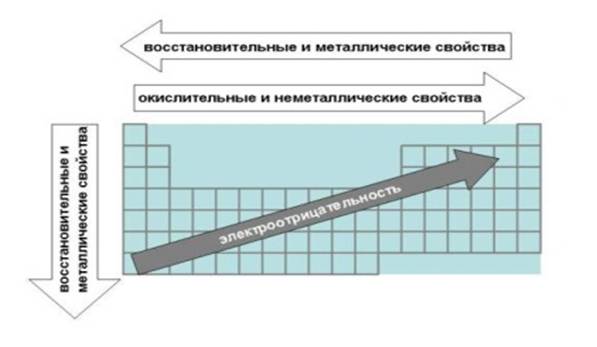
Для оценки способности атома оттягивать на себя общее электронное облако пользуются величиной относительной электроотрицательности. Чем больше относительнаяэлектроотрицательность (ОЭО), тем сильнее атом притягивает к себе электронное облако. Это ведет к тому, что средняя плотность отрицательного электрического заряда оказывается выше, вблизи более электроотрицательного элемента, и ниже, вблизи менее электроотрицательного. В результате первый атом приобретает (–) заряд, а другой - (+). Эти заряды на атомах называют эффективными зарядами атомов в молекуле. Перераспределение электронной плотности внутри молекулы называется окисленностью элемента. Число электронных пар, принятых или отданных атомом, называют степенью окисления.
Так, в молекуле НСl электронная пара смещена в сторону более электроотрицательного Сl и у Сl появляется эффективный заряд, равный 0,17 заряда электрона, у Н такой же положительный заряд. Следовательно, молекула НСl является полярной молекулой. Ее можно рассматривать как систему из двух равных по величине, но противоположных по знаку зарядов, расположенных на определенном расстоянии друг от друга. Такие системы называются электрическими диполями.
Ковалентная связь – наиболее общий вид химической связи, возникающий за счет обобществления электронной пары посредством обменного механизма, когда каждый из взаимодействующих атомов поставляет по одному электрону, или по донорно-акцепторному механизму, если электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору)
Ионная связь – частный случай ковалентной, когда образовавшаяся электронная пара полностью принадлежит более электроотрицательному атому, становящемуся анионом. Основой для выделения этой связи в отдельный тип служит то обстоятельство, что соединения с такой связью можно описывать в электростатическом приближении, считая ионную связь обусловленной притяжением положительных и отрицательных ионов. Взаимодействие ионов противоположного знака не зависит от направления, а кулоновские силы не обладают свойством насыщености. Поэтому каждый ион в ионном соединении притягивает такое число ионов противоположного знака, чтобы образовалась кристаллическая решетка ионного типа. В ионном кристалле нет молекул. Каждый ион окружен определенным числом ионов другого знака (координационное число иона). Ионные пары могут существовать в газообразном состоянии в виде полярных молекул
Водородная связь. Ее образование обусловленно тем, что в результате сильного смещения электронной пары к электроотрицательному атому атом водорода, обладающий эффективным положительным зарядом, может взаимодействовать с другим электроотрицательным атомом (F, O, N, реже Cl, Br, S)
Металлическая связь возникает в результате частичной делокализации валентных электронов, которые достаточно свободно движутся в решетке металлов, электростатически взаимодействуя с положительно заряженными ионами. Силы связи не локализованы и не направлены, а делокализированные электроны обусловливают высокую тепло- и электропроводность.
Ван-дер-ваальсова (межмолекулярная) связь – наиболее универсальный вид межмолекулярной связи, обусловлен дисперсионными силами (индуцированный диполь – индуцированный диполь), индукционным взаимодействием (постоянный диполь – индуцированный диполь) и ориентационным взаимодействием (постоянный диполь – постоянный диполь)
11.
Закономерности, связанные с валентностью элементов.
8. Элементы одной и той же подгруппы (в короткой форме таблицы) или группы (в длинной) имеют аналогичную конфигурацию внешних электронных оболочек и, следовательно, одинаковую валентность в соединениях с другими элементами.
9. s-Элементы имеют валентности, совпадающие с номером их группы (в любой форме таблицы).
10. p-Элементы имеют наибольшую возможную для них валентность, равную номеру группы в короткой форме Периодической таблицы. Кроме того, они могут иметь валентность, равную разности между числом 8 (октет) и номером их группы в короткой форме таблицы (этот номер совпадает с числом электронов на внешней оболочке).
11. d-Элементы обычно обнаруживают несколько разных валентностей, которые нельзя точно предсказать по номеру группы.
12. Не только элементы, но и многие их соединения - оксиды, гидриды, соединения с галогенами - обнаруживают периодичность. Для каждой ГРУППЫ элементов можно записать формулы соединений, которые периодически "повторяются" (то есть могут быть записаны в виде обобщенной формулы).
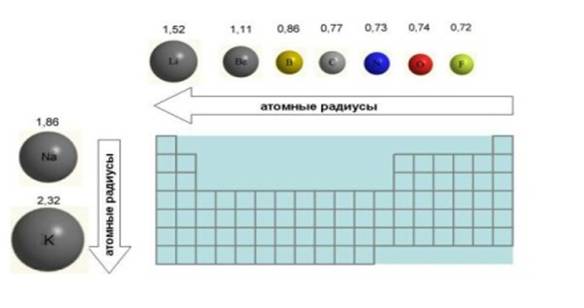
а) Размеры атомов и ионов. Вследствие волновой природы электрона * атом не имеет строго определенных границ. Радиусы атомов и ионов являются условными величинами. Их обычно вычисляют из межатомных расстояний, которые зависят не только от природы атомов, но также и от вида химической связи между ними.
Зависимость атомных радиусов (r) от заряда ядра (Z) имеет периодический характер. В пределах одного периода с увеличением Z проявляется тенденция к уменьшению размеров атомов. Например, во втором периоде атомные радиусы имеют следующие значения:
б) Энергия ионизации и сродство к электрону. В химических реакциях ядра атомов не подвергаются изменению, электронная же оболочка перестраивается, причем атомы способны превращаться в положительно и отрицательно заряженные ионы. Эта способность может быть количественно оценена энергией ионизации атома и его сродством к электрону.
Энергией ионизации (потенциалом ионизации) I называется количество энергии, необходимое для отрыва электрона от невозбужденного атома с образованием катиона:
 2018-01-21
2018-01-21 444
444






