Химия. Билеты.
1 билет: Квантово- механическая модель атома водорода. Волновая функция – ψ. Физический смысл квадрата волновой функции – (ψ2).
Модель атома водорода: атом водорода состоит из двух элементарных частиц – протона и электрона (обе частицы несут в себе одиночных электрический заряд: протон + и электрон -). Простейшей моделью, объяснявшей основные свойства атома водорода, была планетарная модель Резерфорда – Бора. Она описывает атом как планетарную систему – тяжелый протон в центра (ядро атома), а вокруг него вращается легкий электрон. Область пространства вокруг ядра, в котором движется электрон, стала называться орбиталью
Волновая функция. Исходя из представления о наличии у электрона волновых свойств, Э. Шредингер в 1925 г. Предположил, что состояние движущегося в атоме электрона должно описывать известное в физике уравнение стоячей электромагнитной волны. Подставив в это уравнение вместо длины волны ее значение из уравнения де Бройля, он получил новое уравнение, связывающее энергию электрона с пространственными координатами и так называемой волновой функции ψ, соответствующей в этом уравнении амплитуде трехмерного волнового процесса.
|
|
|
Особенно важное значение для характеристики состояния электрона имеет волновая функция ψ. Подобно амплитуде любого волнового процесса, она может принимать как положительные, так и отрицательные значения. Однако величина ψ2 всегда положительна. При этом она обладает замечательным свойством: чем больше значение ψ2 в данной области пространства, тем выше вероятность того, что электрон проявит здесь свое действие, т.е. что его существование будет обнаружено в каком-либо физическом прочесе.
Более точным будет следующее утверждение: вероятность обнаружения электрона в некотором малом объеме ΔV выражается произведением ψ2 ΔV. Таким образом сама величина ψ2 выражает плотность вероятности нахождения электрона в соответствующей области пространства.
2 билет: Квантовые числа: n, l, ml, ms; физический смысл, цифровые значения. Атомная орбиталь. Типы атомных орбиталей (AO).
Атомная орбиталь определяется тремя квантовыми числами:
Главное квантовое число (n).
N определяет возможные энергетические состояния электрона в атоме, может принимать только положительные целочисленные значения: 1,2,3… при 1 энергия электрона минимальна, с увеличением n энергия электрона возрастает. Поэтому состояние электрона, характеризующееся определенным значением n, принято называть энергетическим уровнем электрона в атоме.
N определяет размеры электронного облака. Электроны же, характеризующиеся одим и тем же n, образуют в атоме электронные облака приблизительно одинакового размера, поэтому можно говорить о существовании в атоме электронных слоем, или электронных оболочек, отвечающих определенным значениям n.
|
|
|
орбитальное квантовое число (l).
Форма электронного облака не может быть произвольной. Она определяется l, которое может принимать целочисленные значения от 0 до (n-1). В атоме водорода энергия электрона полностью определяется значением n. Однако в многоэлектронных атомах энергия электрона зависит и от значения орбитального квантового числа. Поэтому состояние электрона, характеризующиеся различными значениями l, принято называть энергетическими подуровнями электрона в атоме (s, p, d, f).
3) магнитное и спиновое квантовые числа (ml, ms).
Из уравнения Шредингера следует, что и ориентация электронного облака в пространстве не может быть произвольной: она определяется значением третьего квантового числа – магнитного (m). Магнитное квантовое число может принимать любые целочисленные значения – как положительные, так и отрицательные – в пределах от +l до –l. Таким образом, для разных значений l число возможных значений m различно. Так, для s электронов (l=0) возможно только одно значение m (m=0). Для p электронов (l=1) возможно три значения m (-1,0,+1); при l =2 (d электроны) m может принимать пять значений -2, -1, 0, 1, 2.
Состояние электрона в атоме, характеризующиеся определенными значениями квантовых чисел n,m,l т.е. определенными размерами, формой и ориентацией в пространстве электронного облака, получила название атомной электронной орбитали. Исследование атомных спектров привели в выводу, что, помимо квантовых чисел n, l, m, электрон характеризуется еще одной квантовой величиной, не связанной с движением электрона вокруг ядра, а определяющей его собственное состояние. Эта величина получила название спиновое квантовое число или просто спина. Спин электрона может иметь только два значения - +1/2 и -1/2; таким образом, как и в случае остальных квантовых чисел возможные значения спинового квантового числа различаются на единицу.
Четыре квантовых числа полностью определяют состояние электрона в атоме.
Типы атомных орбиталей:
Положение элемента в Периодической системе определяет тип орбиталей его атомов (s-, p-, d-, f-АО и т.д.), различающихся энергией, формой, размерами и пространственной направленностью.
Билет: Принципы формирования электронной оболочки многоэлектронных атомов: принцип минимума энергии, принцип Паули, правило Хунда, правило Клечковского. Привести примеры. Определить емкость уровня, подуровня, орбитали.
1) Принцип Паули. Для определения состояния электрона в многоэлектронном атоме важное значение имеет сформулированное Паули положение, согласно которому в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковыми. Из этого следует, что каждая атомная орбиталь, характеризующаяся определенными значениями n,l,m может быть занята не больше чем двумя электронами, спины которых имеют противоположные знаки. Два таких электрона, находящиеся на одной орбитали и обладающие противоположно направленными спинами, называются спаренными, в отличие от одиночного электрона, занимающего определенную орбиталь. Наиболее устойчивое состояние электрона в атоме соответствуем минимально возможному значению его энергии. Любое другое его состояние является возбужденным, неустойчивым: из него электрон самопроизвольно переходит в состояние с более низкой энергией. Поэтому в невозбужденном атоме водорода (заряд ядра равен 1) единственный электрон находится в самом низком из возможных энергетических состояний, т е на 1s подуровне.
|
|
|
2) Правило Хунда: устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атому максимально. Отметим, что правило Хунда не заприщает другого распределения электронов в пределах подуровня. Оно лишь утверждает, что максимальное значение суммарного спина атома соответствует устойчивому, т е невозбужденному состоянию, в котором атом обладает наименьшей возможной энергией; при любом другом распределении электронов энергия атома будет иметь большее значение, так что он будет находится в возбужденном сосоянии.
3) Первое правило Клечковского: при увеличении заряда ядра атома последовательное заполнение электронных орбиталей происходит от орбиталей с меньшем значением суммы главного и орбитального квантовых чисел (n+l) к орбиталям с большим значением этой суммы. Электронное строение калия и кальция соответствует этому правилу. Действительно, для 3d орбиталей (n=3, l=2) сумма (n+l) равна 5, а для 4s орбитали (n=4, l=3) равна 4. Следовательно, 4s подуровень должен заполняться раньше, чем подуровень 3d, что в действительности и происходит.
4) Второе правило Клечковского: при одинаковых значениях суммы (n+l) заполнение орбитали происходит последовательно в направление возрастания значения главного квантового числа n. В соответствии с этим правилом в случае (n+l) равно 5 сначала должен заполнятся подуровень 3d (n=3), затем – подуровень 4p (n=4) и подуровень 5s (n=5). У атома скандия должно начинаться запонение 3d орбитали, так что его электронное строение соответствует формуле…3s23p63d14s2
5) Принцип минимума энергии определяет порядок заселения атомных орбиталей, имеющих различные энергии. Согласно принципу минимума энергии, электроны занимают в первую очередь орбитали, имеющие наименьшую энергию. Энергия подуровней растет в ряду:
1 s < 2 s < 2 p < 3 s < 3 p < 4 s < 3 d < 4 p < 5 s < 4 d < 5 p < 6 s < 4 f 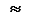 5 d < 6 p < 7 s < 5 f
5 d < 6 p < 7 s < 5 f 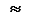 6 d...
6 d...
 2018-01-21
2018-01-21 1205
1205







