Федеральное агентство по образованию
Государственное образовательное учреждение высшего
Профессионального образования
Тульский государственный университет
Кафедра химии
ХИМИЯ И НЕОРГАНИЧЕСКАЯ ХИМИЯ
ЛАБОРАТОРНЫЕ РАБОТЫ
Методические указания для студентов
инженерных специальностей и 060101 – Лечебное дело
Очной формы обучения
Тула 2009
Разработали: Хлебникова С.Ф., к.х.н., доцент
Асулян Л.Д., к.х.н., доцент
Демкина И.И., к.х.н., доцент
Морозова Н.А., к.х.н., доцент
Горячева А.А., к.х.н., доцент
С О Д Е Р Ж А Н И Е
Лабораторная работа № 1
СВОЙСТВА ГИДРОКСИДОВ……………………..……………………...4
Лабораторная работа № 2
ТИТРОВАНИЕ РАСТВОРОВ. ОПРЕДЕЛЕНИЕ ЖЕСТКОСТИ ВОДОПРОВОДНОЙ ВОДЫ.. 7
Лабораторная работа №3
ОПРЕДЕЛЕНИЕ ЭНТАЛЬПИИ РЕАКЦИИ НЕЙТРАЛИЗАЦИИ
СИЛЬНОЙ КИСЛОТЫ СИЛЬНЫМ ОСНОВАНИЕМ…………………20
Лабораторная работа №4
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ И ХИМИЧЕСКОЕ
РАВНОВЕСИЕ. 28
Лабораторная работа №5
|
|
|
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ.. 34
Лабораторная работа №6
ГИДРОЛИЗ СОЛЕЙ.. 38
Лабораторная работа №7
ОПРЕДЕЛЕНИЕ ЭЛЕКТРОПРОВОДНОВТИ РАСТВОРА И
КОНСТАНТЫ ДИССОЦИАЦИИ СЛАБОГО ЭЛЕКТРОЛИТА………40
Лабораторная работа №8
СВОЙСТВА СОЕДИНЕНИЙ d-ЭЛЕМЕНТОВ.. 45
Лабораторная работа №9
ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ.. 51
Лабораторная работа №10
КОРРОЗИЯ МЕТАЛЛОВ И МЕТОДЫ ЗАЩИТЫ.. 55
Лабораторная работа № 1
С ВОЙСТВА ГИДРОКСИДОВ
Цель работы
Изучить реакции получения и свойства гидроксидов.
1.2. Объекты и средства исследования:
0,5М растворы сульфата меди(II), сульфата алюминия, хлорида хрома(III), силиката натрия, 2M растворы хлористоводородной кислоты, гидроксида натрия, гидроксида бария, хромовый ангидрид – кристаллический, универсальная индикаторная бумага.
Программа работы
1.3.1. Получение и установление характера гидроксида меди.
В две пробирки налить по 5 капель раствора соли меди. В каждую пробирку добавить по каплям 2М раствор щелочи до образования осадка. Отметить цвет осадка. В одну пробирку добавить 10-15 капель 2М раствора хлористоводородной кислоты, в другую - 10-15 капель 2М раствора щелочи. Написать уравнения реакций в молекулярном и ионном виде.
Сделать выводы о способе получения и характере гидроксида.
1.3.2. Получение и установление характера гидроксида алюминия.
В пробирку налить 5-10 капель раствора соли алюминия, добавить по каплям 2М раствор щелочи до образования осадка и разделить осадок на две части. К одной прилить 10-15 капель 2М раствора хлористоводородной кислоты, к другой – 10-15 капель 2М раствора щелочи. Написать уравнения реакций в молекулярном и ионном виде.
|
|
|
Учтите, что при взаимодействии гидроксида алюминия с растворами щелочей образуются комплексные соединения – Na[Al(OH)4] или Na3[Al(OH)6]
Сделать выводы о способе получения и характере гидроксида.
1.3.3. Получение и установление характера гидроксида кремния.
Налить в пробирку 5 капель силиката натрия и добавить раствор хлористоводородной кислоты до выпадения студенистого осадка. Осадок разделить на две части, к одной прилить 10-15 капель 2М раствора хлористоводородной кислоты, к другой - 10-15 капель 2М раствора щелочи. Написать уравнения реакций в молекулярном и ионном виде.
Сделать выводы о способе получения и характере гидроксида.
1.3.4. Зависимость характера гидроксидов d -элементов от степени окисления (на примере соединений хрома).
1.3.4.а. Налить в пробирку 5 капель раствора хлорида хрома (III) и прилить к нему по каплям 2М раствор щелочи до появления серо-зеленого осадка гидроксида хрома (III). Установить характер полученного гидроксида. Написать молекулярные и ионные уравнения проведенных реакций.
Сделать вывод о характере гидроксида хрома (III).
1.3.4.б. Несколько кристалликов оксида хрома (VI) поместить в пробирку, прилить 2-3 мл дистиллированной воды. Написать уравнения реакций взаимодействия хромового ангидрида с водой. Установить характер гидроксида хрома (VI) по взаимодействию его с гидроксидом бария. Написать уравнение реакции.
На основании 1.3.4.а и 1.3.4.б сделать вывод о зависимости характера гидроксидов хрома от степени окисления.
1.5. Контрольные вопросы.
1.5.1. Назовите соединения А, B и С. К каким классам соединений они относятся?
1.5.2. Определите степень окисления подчеркнутого элемента в соединении В.
1.5.3. Напишите уравнения реакций, характеризующих свойства соединения С. Приведите примеры реакций его получения.
| Номер варианта | A | B | C | |
| KHSO3 CuO (BeOH)2CO3 HNO2 H2WO4 Na3AsO4 NaHAsO3 CuOH FeO Cd(OH)2 SiO2 CrO3 B2O3 Fe(OH)3 Ba(OH)2 KOH Al(OH)2Cl FeOH(NO3)2 HClO4 Mg(OH)2 KHS (NH4)2SO4 N2O5 H2SiO3 Fe(OH)2 CrOHSO4 AgNO3 Mn2O7 HMnO4 KNO2 | Al(OH)3 H3PO4 P2O5 K2HВO3 CuOHNO3 H2S HBr Ca(HCO3)2 Na3PO4 Fe2O3 Zn(OH)2 AlOHCl2 NaAlO2 ZnCO3 NH4NO3 LiHSO4 HI H2S NiO CuS SeO3 Sr(OH)2 Ni(PO4)2 NaHCO3 H2MoO4 Cl2O7 Fe(OH)2 Sn(OH)2Cl BaO, Ca(ClO4)2 | K2 Сr 2O7 KH S O4 NH4 N O3 I 2O5 Fe C O3 (CuOH)2 S O4 Ca3(Р О4)2 H Cl O4 CuOH N O3 Zn C O3 Li2 S O4 Na Cr O2 H N O2 Ge Сl4 NaH S O3 H Cl O3 K2 Cr O4 Ba S O4 Ca C O3 Cr O3 N H4NO3 H3 As O4 NaH2 B O3 Fe 2(SO4)3 (NH4)2 S O4 H Cl O H Br O3 KH S O3 Zn(OH) N O3 H2 Cr O4 | SeO2 Zn(OH)2 H2CO3 Ni(OH)2 KOH H2SeO3 NaOH Sn(OH)2 H2SO4 K2O HClO4 HMnO4 Рb(ОН)2 HCl ZnO MgO BaO CsOH Be(OH)2 H3PO4 SO2 Na2O Pb(OH)2 Ca(OH)2 MnO2 Cd(OH)2 P2O5 Mg(OH)2 CaO Ba(OH)2 | |
1.6. Приложение.
Названия наиболее распространенных кислот и их анионов
| Формула | Название кислоты | Название аниона кислоты |
| HF HCl HBr HI H2S HCN H3BO3 H2CO3 CH3COOH H2SiO3 HNO2 HNO3 H3PO4 H3AsO3 H3AsO4 H2SO3 H2SO4 H2SeO4 HClO HClO2 HClO3 HClO4 HBrO3 HIO3 H2CrO4 H2Cr2O7 HMnO4 | фтороводородная (плавиковая) хлороводородная (соляная) бромоводородная иодоводородная сероводородная циановодородная борная угольная уксусная кремниевая азотистая азотная фосфорная мышьяковистая мышьяковая сернистая серная селеновая хлорноватистая хлористая хлорноватая хлорная бромноватая йодноватая хромовая дихромовая марганцовая | фторид хлорид бромид иодид сульфид цианид борат карбонат ацетат силикат нитрит нитрат фосфат арсенит арсенат сульфит сульфат селенат гипохлорит хлорит хлорат перхлорат бромат иодат хромат дихромат перманганат |
Лабораторная работа № 2
ТИТРОВАНИЕ РАСТВОРОВ. ОПРЕДЕЛЕНИЕ ЖЕСТКОСТИ ВОДОПРОВОДНОЙ ВОДЫ
2.1. Цель и задачи работы
· Изучить метод объемного анализа растворов (титрование) при определении временной жесткости водопроводной воды.
· Научиться производить расчеты по концентрации электролитов и жесткости воды.
|
|
|
2.2. Теоретические сведения
2.2.1. Способы выражения концентраций растворов
Концентрацией раствора называется содержание растворенного вещества в определенной массе или объеме раствора или растворителя.
| Способ выражения концентрации | Формула | |
| Название и определение | Обозначения и единица измерения | |
| Массовая доля – число граммов растворенного вещества в 100г раствора | ω, % |  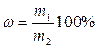
|
| Молярная – число моль растворенного вещества на 1 литр раствора | См или М, 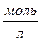
| 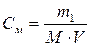
|
| Эквивалентная (нормальная) – число моль эквивалентов растворенного вещества на 1 литр раствора | Cн или н , 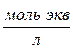
| 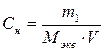
|
| Титр раствора – число граммов растворенного вещества, содержащихся в 1 мл раствора | Т, 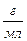
| 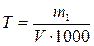
|
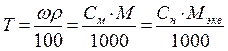 , где
, где
m1 – масса растворенного вещества, г
m2 – масса раствора, г
V – объем раствора, л
М – молярная масса, г/моль
Мэкв – молярная масса эквивалентов, г/моль экв
r - плотность раствора, г/см3 (г/мл)
ω – массовая доля, %
Основные понятия химии и единицы их измерения в системе СИ:
1. Основная единица измерения количества вещества - МОЛЬ. МОЛЬ - количество вещества, содержащее столько же структурных единиц (молекул, атомов, ионов, электронов), сколько содержится атомов в 12 г изотопа углерода С12, то есть 6,02×1023 моль-1. Поэтому необходимо указать, например, "моль молекул воды", "моль атомов водорода", "моль ионов магния".
2. Молярная масса - масса 1 моль вещества. Обозначение М, единицы измерения г/моль.
Например: 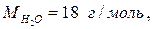
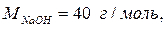
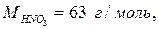
3. Эквивалент - реальная или условная частица вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим способом эквивалентна одному иону водорода в кислотно-основных или ионообменных реакциях или одному электрону в окислительно-восстановительных реакциях.
4. Молярная масса эквивалентов – масса 1 моль эквивалентов, содержащая 6,027×1023 эквивалентов. Обозначение МЭКВ, единицы измерения г/моль (или г/моль.экв).
Молярная масса - это абсолютная константа индивидуального вещества. Молярная масса эквивалента - константа вещества в конкретной реакции.
|
|
|
Ниже приведены формулы для вычисления эквивалентных масс сложных веществ:
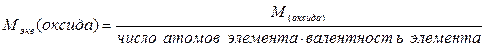
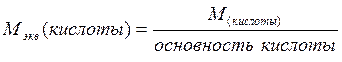
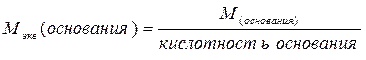
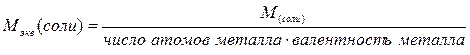
где: М - молярная масса соединения
Основность кислоты определяется числом ионов водорода, которое отдает молекула кислоты, реагируя с основанием.
Количество гидроксильных групп в молекуле основания определяет его кислотность.
Примеры расчетов:
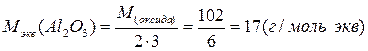
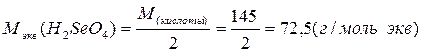
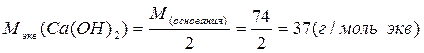
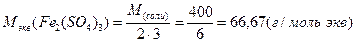
Молярная масса эквивалента одного и того же вещества зависит от течения реакции:
H2SO4 + NaOH = NaHSO4 + H2O
H2SO4 + 2NaOH = Na2SO4 + 2H2O
В первом случае эквивалентная масса H2SO4 равна ее молярной массе, во втором - половине молярной массы, так как в первом случае в реакции принимает участие один атом водорода, а во втором два атома водорода
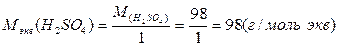
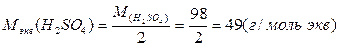
Раствор, содержащий в одном литре один моль растворенного вещества, называется одномолярным (1,0 М); 0,1 моль – децимолярным (0,1 М); 0,01 моль эквивалента – сантимолярным (0,01 М).
Раствор, содержащий в одном литре один моль эквивалентов растворенного вещества, называется однонормальным (1,0 н.); 0,1 моль эквивалента – децинормальным (0,1 н.); 0,01 моль эквивалента – сантинормальным (0,01 н.).
Растворы различной концентрации реагируют в объемах обратно пропорциональных их нормальным концентрациям (закон эквивалентов для растворов):
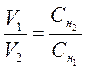
Если концентрация растворов невелика, например, концентрация солей в природных водах, то вместо эквивалентной концентрации в растворах используют тысячную долю ее - миллиэквивалент (мэкв/л).
Концентрация в миллимолях эквивалентов ионов Са2+ и Mg2+ на литр воды называется жесткостью воды, таким образом:
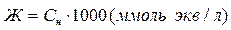
Примеры решения задач по теме «Концентрация растворов»
Задача 1. Какую массу воды и массу соли надо взять для приготовления 40кг раствора с массовой долей сульфата натрия 12%?
Решение:
исходя из формулы 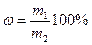 определим массу сульфата натрия:
определим массу сульфата натрия:
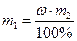 ;
; 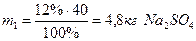
Масса воды равна m2 - m1 = 40 - 4,8 = 35,2 кг Н2О
Ответ: для приготовления 40 кг раствора с массовой долей 12% необходимо взять 4,8 кг сульфата натрия и 35,2 кг воды.
Задача 2. Сколько граммов соды Na2CO3 содержится в 500 мл 0,25 н. раствора?
Решение:
1) Массу соды определяем по формуле эквивалентной концентрации:
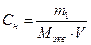 ;
; 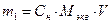
2) Молярную массу эквивалентов соды рассчитаем по формуле:
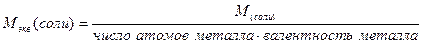
где: 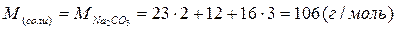 ,
,
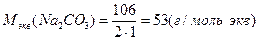
масса соды: m1 = 0,25 × 53 × 0,5 = 6,625 г.
Ответ: в 500 мл 0,25 н.раствора содержится 6,625 г Na2CO3.
Задача 3. Определите массовую долю Н3PO4 в 2 н. растворе плотностью 1,32 г/мл.
Решение:
Массовую долю Н3РО4 определяем исходя из формулы, связывающей массовую долю с эквивалентной концентрацией:
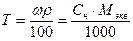 ;
; 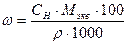 ;
;
где 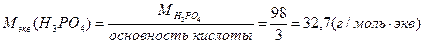 ;
;
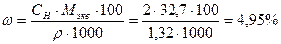
Ответ: массовая доля Н3РО4 в 2 н. растворе, плотностью 1,32 г/мл равна 4,95%.
Задача 4. Какова молярность 20% раствора соляной кислоты (r = 1,10 г/мл)?
Решение:
Исходя из формулы:
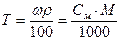
находим: 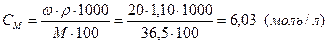
Ответ: молярность 20% раствора НСl равна 6,03 моль/л.
 2017-11-01
2017-11-01 607
607







