Системы с жидкой и твердой дисперсной фазой
Суспензии
Суспензии – дисперсные системы с жидкой дисперсионной средой и твердой дисперсной фазой. Они похожи на золи, но отличаются значительной большим размером частиц. Получают их теми же методами, что и золи – диспергированием и конденсацией. Однако для практических целей суспензии получают чаще всего диспергированием нерастворимых твердых веществ в жидкой среде или взмучиванием в этой среде предварительно полученного порошка.
Не обладая седиментационной устойчивостью, суспензии могут быть устойчивы агрегативно, т. е. их частицы сохраняют постоянные размеры. Агрегативная устойчивость суспензий обусловлена тем, что их частицы имеют на поверхности двойной электрический слой или сольватную оболочку. Механизм образования двойного электрического слоя преимущественно адсорбционный, т. е. он формируется благодаря адсорбции одного из ионов дисперсионной среды электролита. Значение электрокинетического потенциала суспензии близко к потенциалу золя, и агрегативная устойчивость определяется электростатическим отталкиванием одноименно заряженных частиц.
Для получения стабильной суспензии необходимо:
1) достигнуть требуемую степень дисперсности труднорастворимого вещества в жидкой среде;
2) добавкой соответствующих поверхностно-активных веществ добиться, чтобы поверхность частиц дисперсной фазы смачивалась жидкой дисперсионной средой;
3) подобрать и ввести подходящий стабилизатор (электролит, ПАВ или защитный высокополимер).
Суспензии могут быть агрегативно устойчивы и без двойного электрического слоя. При наличии стабилизатора на границе раздела фаз образуются адсорбционные слои, препятствующие слипанию частиц. В случае полимерных стабилизаторов на поверхности частиц суспензии возникают механически прочные поверхностные студнеобразные пленки. При достаточной концентрации суспензии и стабилизатора-высокополимера поверхностные студнеобразные пленки объединяются в единый пространственный каркас-сетку и вся система застудневает.
Суспензии одновременно поглощают и рассеивают свет, хотя их частицы по размеру больше коллоидных частиц, при этом в отличие от опалесцирующих золей суспензии проявляют мутность не только при боковом освещении, но и в проходящем свете. Однако суспензии, так же как и золи, способны проявлять двойственное лучепреломление в потоке.
Поскольку частицы суспензий сравнительно больших размеров, в них нет броуновского движения, а, следовательно, они не проявляют таких молекулярно-кинетических свойств, как диффузия и осмос.
Для суспензий характерен ряд процессов, не свойственных коллоидным системам. К таким процессам относятся седиментация, флотация, фильтрация.
Фильтрация суспензий определяется дисперсностью и степенью агрегации частиц, а также образованием коагуляционной структуры и способностью ее к самоуплотнению в фильтрующем осадке. Поэтому фильтрация является сложным физико-химическим процессом, на который влияют все факторы, управляющие агрегированием частиц и развитием коагуляционных структур.
Суспензии имеют исключительно большое значение в природе и технике, далеко превосходящее значение типичных золей с твердой дисперсной фазой. К суспензиям при достаточном содержании влаги относятся почвы и грунты; глиняное тесто, используемое в гончарном, фаянсовом и фарфоровом производствах; цементные и известковые растворы, краски, лаки применяемые в строительном деле; графитовые и угольные суспензии используются для предотвращения образования накипи на котлах; суспензия металлического никеля применяется в качестве активного катализатора при гидрировании растительных масел; для облегчения процесса бурения применяют глинистые суспензии; в пищевой промышленности к суспензиям относятся шоколадная масса, крахмальное “молоко”, порошок какао в воде, помадные массы кондитерского производства.
Эмульсии
Эмульсии – дисперсные системы, состоящие из двух несмешивающихся жидкостей. Радиус взвешенных капелек жидкости в эмульсиях находится в пределах 10-3–10-5 см. Для образования эмульсий берут жидкости, сильно отличающиеся по типу внутримолекулярных связей. Одна из них должна быть ярко выраженной полярной жидкостью (обычно вода), а вторая неполярная или малополярная (какая-либо органическая жидкость, не растворимая в воде и называемая независимо от ее химического состава “масло”). Обе жидкости, образующие эмульсию, должны быть нерастворимы или малорастворимы друг в друге. В системе должен присутствовать стабилизатор, который в этом случае называется эмульгатором. Эмульсии тем седиментационно устойчивее, чем ближе плотности обеих фаз.
Отличительной особенностью не очень концентрированных эмульсий является сферическая форма частиц (капелек).
От типичных лиофобных эмульсий отличаются так называемые критические лиофильные эмульсии (эмульсолы). Критические эмульсии – это системы, образующиеся обычно из двух ограниченно смешивающихся жидкостей (например, анилина и воды; изоамилового спирта и воды) при температурах, близких к критической температуре смешения, когда поверхностное натяжение на границе раздела фаз становится весьма малым и теплового движения молекул уже достаточно для диспергирования одной жидкости в другой. В результате такого самопроизвольного диспергирования образуется тончайшая эмульсия, в которой коалесценция (сливание) отдельных капелек уравновешивается стремлением обеих жидкостей равномерно распределяться в объеме.
Классификация эмульсий. Обычные лиофобные эмульсии классифицируют либо по полярности дисперсной фазы и дисперсионной среды, либо по концентрации дисперсной фазы в системе.
Согласно первой классификации, различают эмульсии неполярной или слабополярной жидкости в полярной (например, эмульсия масла в воде) – эмульсии первого рода или прямые и эмульсии полярной жидкости в неполярной (например, вода в масле) – эмульсии второго рода или обратные.
Эмульсии первого рода (прямые) обозначают м/в, где под буквой “м” подразумевается масло или иная неполярная жидкость, а под буквой “в” – вода или другая полярная жидкость. Эмульсии второго рода (обратные) обозначают соответственно в/м.
Тип эмульсии легко установить путем определения свойств ее дисперсионной среды. Для этого либо определяют способность эмульсии смачивать гидрофобную поверхность; либо проверяют возможность эмульсии разбавляться водой; либо испытывают способность эмульсии окрашиваться при введении в нее красителя, растворяющегося в дисперсионной среде; либо, наконец, определяют электропроводность эмульсии.
Согласно второй классификации, эмульсии делят на разбавленные, концентрированные и высококонцентрированные или желатинированные.
К разбавленным относятся эмульсии, содержащие до 0,1 % дисперсной фазы. Типичным примером такой системы может служить эмульсия машинного масла в конденсате, образующаяся при работе паровых машин. Разбавленные эмульсии по размеру частиц резко отличаются от концентрированных, являясь наиболее высокодисперсными. Диаметр капелек в разбавленных эмульсиях составляет порядка 10-5 см, т. е. близок к размеру коллоидных частиц. Разбавленные эмульсии обычно образуются без введения в систему специальных эмульгаторов. Частицы этих эмульсий несут электрический заряд, который возникает в результате адсорбции ионов неорганических электролитов, присутствующих в среде в малых количествах.
Разбавленные эмульсии по свойствам более всего сходны с лиофобными золями. Они могут существовать в метастабильном состоянии лишь в очень благоприятных условиях (малая концентрация электролита). Влияние электролитов соответствует правилу Шульце-Гарди, многозарядные ионы изменяют знак заряда частиц, в устойчивых эмульсиях наблюдается заметный электрофорез и т. д.
Примером устойчивых эмульсий является сырая нефть, в которой капельки воды образуют эмульсии обратного типа, а также прямые разбавленные эмульсии масла в воде, образующиеся при конденсации отработанного пара в паровых двигателях.
К концентрированным относятся эмульсии со значительным содержанием дисперсной фазы (до 74 объемных процентов). Эта концентрация является максимальной потому, что она в случае монодисперсной эмульсии соответствует максимально возможному объемному содержанию недеформированных сферических капель независимо от их размеров.
Концентрированные эмульсии обычно получаются методом диспергирования и размер капель относительно велик и составляет 0,1–1,0 мкм и больше, поэтому капельки видны под обычным микроскопом. Такие системы не могут быть устойчивы без стабилизатора, легко седиментируют, причем седиментация происходит тем быстрее, чем больше разница между плотностями дисперсной фазы и дисперсионной среды. Если дисперсная фаза обладает меньшей плотностью, чем среда, то наблюдается всплывание капель дисперсной фазы.
К высококонцентрированным или желатинированным, эмульсиям относят системы с содержанием дисперсной фазы выше 74 объемных процентов. Отличительной особенностью таких эмульсий является взаимное деформирование капелек дисперсной фазы, и они приобретают форму многогранников (полиэдров), разделенных тонкими пленками – прослойками дисперсионной среды. Такая эмульсия при рассмотрении в микроскоп напоминает соты. Вследствие плотной упаковки капелек эти эмульсии не способны седиментировать и обладают свойствами, сходными со свойствами гелей, например, их можно резать ножом.
Высококонцентрированные эмульсии можно приготовить с содержанием дисперсной фазы до 99 %. Например, эмульгируя бензол в 1 % растворе олеата натрия, можно получить эмульсию, содержащую выше 99 процентов объемных дисперсной фазы. В такой предельно концентрированной эмульсии раствор эмульгатора находится между частицами дисперсной фазы в виде тончайших пленок (100 ангстрем и ниже).
Агрегативная устойчивость эмульсий и природа эмульгатора.
Эмульсии, как и все коллоидные системы, агрегативно неустойчивы из-за избытка свободной энергии на межфазной поверхности. Агрегативная неустойчивость эмульсий проявляется в самопроизвольном образовании агрегатов капелек с последующим слиянием (коалесценцией) отдельных капелек друг с другом. Это приводит к полному разрушению эмульсии и разделе ее на два слоя – жидкость дисперсной фазы и жидкость дисперсионной среды.
Агрегативную устойчивость эмульсий характеризуют либо скоростью ее расслаивания, либо продолжительностью существования (время жизни) отдельных капелек в контакте друг с другом или с межфазной поверхностью.
На агрегативную устойчивость эмульсий сильнее всего влияют природа и содержание в системе эмульгатора. Эмульгатор, адсорбируясь на межфазной границе, понижает межфазное поверхностное натяжение и в отдельных случаях может приводить даже к образованию равновесных коллоидных систем. Другое объяснение заключается в том, что при наличии стабилизатора на границе раздела фаз между капельками возникают силы отталкивания (энергетический барьер). Повышение концентрации эмульгатора в системе способствует устойчивости эмульсии.
Природа эмульгатора определяет не только устойчивость, но и тип эмульсии. Опыт показывает, что гидрофильные эмульгаторы, лучше растворимые в воде, чем в углеводородах, способствуют образованию эмульсий типа м/в, а гидрофобные эмульгаторы, лучше растворимые в углеводородах, – эмульсий типа в/м (правило Банкрофта). Это объяснимо, так как эмульгатор препятствует слипанию, или коалесценции, капелек только тогда, когда он находится у поверхности с наружной стороны капелек, т. е. лучше растворяется в дисперсионной среде.
В качестве эмульгаторов могут применяться самые различные по природе вещества: поверхностно-активные вещества, молекулы которых содержат ионогенные полярные группы, неионогенные ПАВ, высокомолекулярные соединения (ВМС). Эффективность эмульгатора характеризуется специальной величиной – гидрофильно-липофильным балансом (ГЛБ). Если число ГЛБ лежит в пределах 3–6, образуются эмульсии типа в/м. Эмульгаторы с числом ГЛБ 8–13 дают эмульсию типа м/в. Изменяя природу эмульгатора и его концентрацию, можно добиться обращения фаз эмульсии.
Стабилизирующее действие мыл и мылоподобных веществ на эмульсии типа м/в объясняется несколькими факторами устойчивости. Первый фактор – электрический заряд, возникший на поверхности капелек эмульсий, стабилизированных ионогенными мылами при адсорбции органических ионов мыла. В результате образуется двойной электрический слой, аналогичный тому, который существует на поверхности частиц типичных гидрофобных золей. Двойной электрический слой и обусловливает устойчивость эмульсий. Поэтому эмульсии м/в характеризуются свойствами, присущими типичным гидрозолям, т. е. для них соблюдается правило Шульце-Гарди, возможность перезарядки частиц эмульсий с помощью поливалентных ионов и т. д.
Чтобы происходила адсорбция органического иона, он должен хорошо адсорбироваться дисперсной фазой, т. е. иметь достаточно длинную углеводородную цепь. Поэтому эмульсии типа м/в могут быть стабилизированы только сравнительно высокомолекулярными мылами (щелочными солями лауриновой и более высокомолекулярных жирных кислот).
Второй фактор устойчивости концентрированных эмульсий типа м/в заключается в образовании на поверхности их капелек структурированных гелеобразных слоев эмульгатора, обладающих высокой структурной вязкостью и прочностью при одновременной гидратированности.
Устойчивость эмульсий типа в/м, стабилизованных мылами с поливалентным катионом, ранее объяснялась наличием на поверхности капелек эмульсии структурно-механического барьера. В последние годы было показано, что даже в неполярных средах может происходить некоторая диссоциация молекул эмульгатора. Соли поливалентных металлов и органических кислот в углеводородных средах обычно имеют константы диссоциации порядка 10-8, следовательно, если, например, концентрация такой соли в бензоле равна 10 ммоль/л, то концентрация ионов в растворе будет иметь значение порядка 10-14.
При таких условиях двойной электрический слой будет очень диффузным, его толщина составит несколько микрометров. Емкость двойного слоя в неполярной жидкости весьма невелика и нужен очень небольшой заряд для того, чтобы обусловить значительный поверхностный потенциал. Таким образом, электростатические силы отталкивания могут играть существенную роль и в устойчивости обратных эмульсий, особенно не очень концентрированных.
Эмульгирующее действие как ионогенных, так и неионогенных ПАВ тем эффективнее, чем лучше сбалансированы полярные и неполярные части молекулы эмульгатора между обеими фазами эмульсии. Дифильная молекула хорошего эмульгатора должна обладать сродством как к полярным, так и к неполярным средам, только в этом случае она будет находиться на межфазной поверхности. Сбалансированность молекул эмульгатора определяется длиной углеводородной цепи и сродством ионогенной или полярной группы к воде (рис. 11.2).
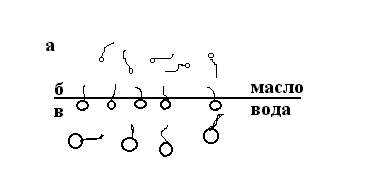
Р ис. 11.2. Поведение различно сбалансированных дифильных молекул эмульгатора:
а – молекулы с преобладающей полярной частью; б – хорошо сбалансированные молекулы; в – молекулы с преобладающей полярной частью
Именно хорошей сбалансированностью объясняется наилучшее стабилизирующее действие мыл, содержащих в углеводородной цепочке от 12 до 18 атомов углерода. Сбалансированностью молекул эмульгатора объясняется и род эмульсий, которые получаются с применением этого эмульгатора. Эмульгаторы с превалирующим действием в молекуле полярной группы над неполярной и которые лучше растворяются в воде, образуют эмульсии первого рода (м/в). Эмульгаторы, у которых действие неполярной группы молекулы преобладает над действием полярной и которые лучше растворяются в углеводородах, способствуют образованию эмульсий второго рода (в/м).
Итак, несомненным и вполне однозначным является факт стабилизации прямых эмульсий (м/в) гидрофильными веществами, обратных (в/м) – гидрофобными. Дисперсионной средой эмульсии становится жидкость, лучше взаимодействующая с эмульгатором.
Уже давно известно, что хорошей стабилизирующей способностью обладают не только ПАВ, но и тонкоизмельченные порошки, например, глина, мел, сажа, гипс и др. При встряхивании полярной жидкости в неполярной в присутствии твердого эмульгатора его крупинки прилипают к межфазной поверхности, причем большая часть поверхности частиц эмульгатора находится в той жидкости, которая их лучше смачивает. На капельках образуется как бы “бронь”, предотвращающая их коалесценцию.
Если твердый эмульгатор лучше смачивается водой (например каолин), такая броня возникает со стороны водной фазы, при этом образуется эмульсия типа м/в. Если же твердый эмульгатор лучше смачивается неполярным углеводородом (например сажа), то образуется эмульсия типа в/м (рис.11.3) В случаях Iа и IIб крупинки твердого эмульгатора находятся с наружной стороны капель и эмульсии устойчивы. В случаях Iб и IIа крупинки твердого эмульгатора находились бы у межфазной поверхности с внутренней стороны капель, в результате чего образование таких эмульсий невозможно.
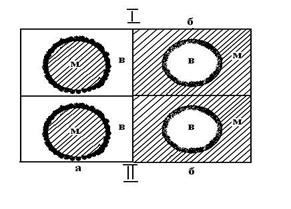
Рис. 11.3. Модель эмульгирующего действия порошковых эмульгаторов:
I – гидрофильный эмульгатор (каолин); II – гидрофобный эмульгатор (сажа)
Стабилизация эмульсий твердыми эмульгаторами возможна только при условии, что размер частиц порошка меньше размера капелек эмульсии. Но слишком малые частицы порошка из-за броуновского движения не прилипают к поверхности капелек и не образуют защитного слоя.
Методы получения и разрушения эмульсий. Эмульсии получают механическим диспергированием фазы в дисперсионной среде в присутствии соответствующего эмульгатора. Жидкости сильно перемешивают, встряхивают, подвергают вибрационному воздействию. Для этого используют специальные мешалки, коллоидные мельницы. Иногда полученные грубые эмульсии подвергают дополнительной гомогенизации в специальных гомогенизаторах разных конструкций. При обработке в таких гомогенизаторах диаметр капелек понижается, при этом значительно увеличивается седиментационная устойчивость.
Часто требуется не получить эмульсию, а предупредить ее образование или разрушить (диэмульгировать) уже полученную систему. Эмульсии типа м/в, полученные с применением ионогенных эмульгаторов, обычно разрушают с помощью коагуляции электролитами с поливалентными ионами.
Эмульсии, стабилизированные неионогенными стабилизаторами, разрушаются гораздо труднее. Эффективным способом разрушения таких эмульсий является нагревание, введение в систему ПАВ, вытесняющего из адсорбционного слоя эмульгатор, но не способного стабилизировать эмульсию. Эмульсии можно также разрушать центрифугированием, фильтрацией, электрофорезом.
Обращение фаз эмульсий. При введении в эмульсию при интенсивном перемешивании большого количества ПАВ, являющегося стабилизатором эмульсий противоположного типа, первоначальная эмульсия может обращаться, т. е. дисперсная фаза становится дисперсионной средой, а дисперсионная среда – дисперсной фазой. Так, эмульсии типа м/в, стабилизованные олеатом натрия, могут быть превращены в эмульсию типа в/м путем введения в систему олеата кальция.
Обращение эмульсий может быть вызвано и длительным механическим воздействием. Так, сбивание сливок (м/в) ведет к получению масла (в/м).
Практическое значение эмульсий. К эмульсиям относятся молоко, сливки, майонез, яичный желток, латексы, битумные эмульсии, средства для опрыскивания растений, эмульсии воды в нефти и др. В фармацевтической промышленности многие лекарства применяются в виде эмульсий; в парфюмерной эмульсии – кремы.
Пены
Пенами называются грубые высококонцентрированные дисперсные системы, в которых дисперсионная среда – жидкость, а дисперсная фаза – газ. Пузырьки газа имеют размеры порядка нескольких миллиметров, а в отдельных случаях и сантиметров, форму многогранников и отделены друг от друга очень тонкими слоями жидкой дисперсионной среды. Пленки часто обнаруживают интерференцию, следовательно, их толщина соизмерима с длиной световых волн. Большой размер газовых пузырьков и тесное расположение их в пене исключают возможность броуновского движения устойчивые пены обладают некоторой жесткостью или механической прочностью. По строению обычные пены напоминают высококонцентрированные эмульсии.
Устойчивую пену можно получить только в присутствии стабилизатора – пенообразователя. Чистые жидкости не обладают способностью образовывать пену, наличие пены всегда говорит о присутствии в жидкости посторонних веществ, загрязнений.
Устойчивость пены зависит от природы пенообразователя, его концентрации, температуры, вязкости жидкости и присутствия электролитов. К типичным пенообразователям водных пен относятся такие ПАВ, как мыла, спирты, белки, сапонин, жирные кислоты и т. д. Низкомолекулярные ПАВ, уменьшая поверхностное натяжение (s), облегчают образование пены, но не придают ей стабильности, и она быстро разрушается. Пенообразующие вещества с длинной молекулярной цепью, адсорбируясь на границе вода –воздух, образуют высоковязкую структурированную пену, препятствующую стеканию жидкости. Толщина слоя жидкости между пузырьками газа уменьшается медленно, и пена может существовать долго.
С увеличением вязкости жидкости устойчивость пены возрастает. Электролиты, как правило, снижают время жизни пены. Таким образом, существует несколько факторов, объясняющих устойчивость пен. В настоящее время все больше исследователей приходят к выводу, что вообще не может быть единой теории устойчивости пен и что причины существования пен не зависят от пенообразователей и условий получения.
Методы получения и разрушения пен, их практическое значение. Пены получают путем пропускания пузырьков соответствующего газа (обычно воздуха) через раствор пенообразователя или путем интенсивного механического перемешивания раствора пенообразователя.
В ряде случаев образование пены нежелательно, она мешает перемешиванию и выпариванию жидкостей. Особенно вредны пены, образующиеся в сточных водах, которые содержат пенообразователи. Эти пены покрывают поверхность водоемов и, прекращая доступ кислорода в воду, убивают все живое. Пену можно разрушить введением в нее веществ, которые, обладая высокой поверхностной активностью, сами не дают пены. Такие вещества получили название пеногасителей. Эффективными пеногасителями являются сложные эфиры, жирные кислоты, спирты.
Другой метод пеногашения заключается в “пережигании” пены при воздействии высоких температур. Пены можно разрушить и механическим путем, продувая воздух над поверхностью пенящейся жидкости при кипении. Пленка как бы высыхает, и пузырьки образовавшейся пены разрушаются.
Пенообразование и пены имеют большое практическое значение. Известно положительное действие пен, мыла и других моющих средств при удалении загрязнений с любой поверхности. Очень важным является использование пен при тушении пожаров. Применяемая в этом случае пена содержит в виде дисперсной фазы диоксид углерода, имеет невысокую плотность, что позволяет применять ее для тушения горящих органических жидкостей. Устойчивые пены широко используются в флотационных процессах, например, при обогащении руд и минералов.
Эмульсии – дисперсные системы, состоящие из двух несмешивающихся жидкостей. Радиус взвешенных капелек жидкости в эмульсиях находится в пределах 10-3–10-5 см. Для образования эмульсий берут жидкости, сильно отличающиеся по типу внутримолекулярных связей. Одна из них должна быть ярко выраженной полярной жидкостью (обычно вода), а вторая неполярная или малополярная (какая-либо органическая жидкость, не растворимая в воде и называемая независимо от ее химического состава “масло”). Обе жидкости, образующие эмульсию, должны быть нерастворимы или малорастворимы друг в друге. В системе должен присутствовать стабилизатор, который в этом случае называется эмульгатором. Эмульсии тем седиментационно устойчивее, чем ближе плотности обеих фаз.
 2014-01-31
2014-01-31 3114
3114








