Молекулярно-кинетическая теория газов (МКТ) и выводы из нее.
Дальтониды и бертоллиды.
Химического элемента, химическая формула, ее типы. Степень окисления
АМУ, его постулаты и создатели.
Этапы развития химии.
Охраны окружающей среды, в жизни человека.
В познании природы, развитии техники и промышленного производства,
Интеграция с физикой, электроникой и другими науками. Значение химии
Место химии в системе естественных наук, ее дифференциация и
Супрамолекулярная химия.
Задачи химии. Атомно-молекулярное учение (АМУ). Основные понятия химии.
Вопросы: 1. Химия и материя. Наноструктурный уровень организации материи.
5. Основные понятия химии: вещество, химический элемент, элементарные
частицы, атом, молекула, массы частиц: абсолютные и относительные,
моль и молярные массы атома, молекулы; число Авогадро; Символ атома
(с.о.) и валентность (В), химические реакция и уравнение, схема реакции.
| Раздел 1. Общая химия | Самостоятельная работа | ||
| 1.1 – 1. Химия - часть естествознания. Атомно-молекулярное учение (АМУ).. | 1. Химия и материя. Вещество и поле, их взаимосвязь. Наноструктурный уровень организации материи. 2. Место химии в системе естественных наук, ее специфика и интеграция с физикой и другими науками. Понятия системы, целостности, иерархии в науке, в химии. 3. Основные разделы современной химии. Общая химия как основа системы химических знаний. 4. Периодизации развития химии. 5. АМУ, его постулаты и создатели. | (1) 1. Основные этапы в развитии химии. 2. Наноуровень строе ния материи. Типы наночастиц, структур. 3. Наука как единство знания и деятельности Методы получения научных знаний: гипо теза,наблюдение,опыт, обобщение, теоретиче ское обоснование. |
Лекция № 2
|
|
|
Тема: Основные теории и законы химии. Стехиометрия и основные стехиометрические законы химии.
Вопросы: 1. Основные теории и законы химии: АМУ, Периодический закон и Периодическая система Д.И. Менделеева, теория строения вещества А.М. Бутлерова, стехиометрические законы химии.
2. Понятие стехиометрии.
Основные стехиометрические законы химии:
1) сохранения массы веществ и энергии;
2) постоянства состава и 2 следствия из него;
3) эквивалентов;
4) кратных отношений.
3. Газовые законы (стехиометрические):
5) Авогадро и основные следствия из него;
6) объемных отношений – «химический» закон Гей-Люссака);
7) Бойля-Мариотта и 2 следствия из него;
8) Гей-Люссака;
9) Шарля;
10) Клапейрона – Менделеева – основной (объединенный) закон
идеального газового состояния;
11) Дальтона – парциальных давлений.
Самостоятельная работа:
К основным стехиометрическим законам химии
|
|
|
1. Закон постоянства состава химических соединений (Ж.-Л.Пруст, 1808):
Например, вода, полученная в различных химических реакциях и взятая из разных мест и источников, имеет один и тот же качественный (элементный) и количественный состав, выражаемый единой молекулярной формулой, Н2О:
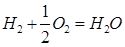 и
и 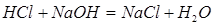 .
.
Согласно закону постоянства состава индексы в молекулярной формуле вещества, определяющие количества атомов химических элементов, входящих в состав молекулы, всегда постоянны и целочисленны. Подчеркиваем, что этот закон относится только к молекулярным соединениям (дальтонидам).
Исследования в области физики твердого тела и теории реальных кристаллов показывают, что существует много веществ кристаллической структуры с переменным составом. Например, оксид титана в зависимости от давления кислорода может иметь состав от TiO0,5 до TiO1,35. Такие соединения были названы бертоллидами в отличие от дальтонидов, в которых закон постоянства состава соблюдается. Соединения с нарушенным стехиометрическим составом, как правило, обладают полупроводниковыми свойствами. Например, Cu2O0,9 – является полупроводником с n –типом проводимости.
Количественный состав и свойства бертоллидов, соединений с нарушенным стехиометрическим составом зависят от способа и условий их получения (давление, температура, состав реакционной системы).
2. Закон эквивалентов (И. Рихтер, 1773):
Вещества взаимодействуют между собой и образуются в эквивалентных количествах, т.е. пропорциональных их эквивалентам; при этом массы вступающих в реакцию веществ относятся друг к другу как их эквивалентные массы, т.е.: m(1)/m(2) = МЭ(1)/МЭ(2)
Таким образом, зная массу одного из вступивших в реакцию веществ, можно определить массу другого прореагировавшего вещества, предварительно рассчитав эквивалентные массы обоих веществ.
Для химических реакций с участием газообразных веществ (в условиях, близких к нормальным) закон эквивалентов формулируют несколько иначе:
Отношения масс и молярных эквивалентных масс газообразных веществ пропорциональны отношениям их объемов (V) и молярных эквивалентных объемов (VЭ), т.е.: m(1)/m(2) = МЭ(1)/МЭ(2) = V(1)/V(2) = VЭ(1)/VЭ(2). ___________________________________________________________________
Для понимания закона эквивалентов необходимо ввести основополагающие термины и понятия, позволяющие использовать его.
1. Эквивалент вещества (или элемента в химическом соединении)- это:
а) такое его количество (моль), которое способно взаимодействовать с одним эквивалентом (1 моль атомов) водорода в кислотно-основных, ионообменных реакциях или с одним эквивалентом (1моль) электронов в окислительно-восстановительных реакциях.
(Это определение эквивалента имеет больший физический смысл, чем следующее, известное (предложенное ИЮПАК), не противореча ему)
б) э квивалент – это условная или реальная частица, способная присоединять, замещать или каким-либо иным образом взаимодействовать с одним атомом водорода в кислотно-основных (ионообменных) реакциях или с одним электроном в окислительно-восстановительных реакциях.
2. В общем случае эквивалент (Э) любого вещества Х (элемента Х) определяют как Э(Х) = 1моль(Х)/ пЭ (Х), где пЭ — число эквивалентов, иначе, число молей эквивалентов, содержащихся в одном моле вещества (или атомов элемента).
Величина, обратная числу эквивалентов) — фактор эквивалентностиfЭ этого вещества (элемента): fЭ = 1/пЭ.
Фактор эквивалентности показывает, какую часть моля вещества (атомов элемента) составляет один эквивалент его.
Таким образом, эквивалент вещества (химического элемента) всегда меньше или равен 1 моль: Э(Х) ≤ 1 моль
3. Важно отметить, что пЭ, число эквивалентов (а значит, и Э, эквивалент) в химическом соединении, определяют различно для вещества (химического
|
|
|
соединения) в целом и какого-либо отдельного элемента в данном химическом соединении:
пЭ (вещества, химического соединения) = n.k,
пЭ (химического элемента) = n,
где n — валентность (степень окисленности) какого-либо химического элемента в данном соединении, k – количество (число) его атомов.
4. В сложном соединпении (состоящем из двух и более элементов) число эквивалентов, а значит, и эквивалент его, и фактор эквивалентности определяют по отношению к какому-либо одному химическому элементу или иону, способному вступать в реакцию,- любому в составе соединения:
пЭ (Мп2О7) = п(Мп). К(Мп) = п(О). к(О) = 7. 2 = 14 эквивалентов, Э;
Э (Мп2О7) = 1 моль/пЭ = 1/14, моль; fЭ = 1/14 часть моля Мп2О7;
пЭ (СаСО3) = п(Са). к(Са) = п(СО32-). к(СО32-) =2.1 = 2Э,
Э(СаСО3) = 1 моль/пЭ = ½, моль; fЭ = ½ часть моляСаСО3.
5. Для одновалентных элементов в химическом соединении значения чисел эквивалентов (п Э) вещества и химического элемента и, соответственно, их эквиваленты ( и факторы эквивалентности) — совпадают, одинаковы. Для многовалентных (двух- и более-валентных) химических элементов число эквивалентов пЭ (вещества, элемента) больше значения их эквивалента Э (и фактора эквивалентности) и равно числу, обратному их фактору эквивалентности fЭ.
Например: а) в соединении HCl эквивалент хлора ЭCl = 1 моль и эквивалент хлороводорода Э( HCl) = 1 моль, число эквивалентов и фактор эквивалентности: пЭ (Cl, HCl) = 1эквивалент (Э), fЭ (Cl, HCl) = 1;
б) в соединении Н2О эквивалент водорода Э (Н) = 1 моль и пЭ (Н) = 1 Э, fЭ (Н) = 1, а эквивалент кислорода Э (О) = 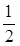 моль и эквивалент воды Э (Н2О) = 1/2 моль, fЭ (О,Н2О) = ½; пЭ (О,Н2О) = 2 эквивалента (Э);
моль и эквивалент воды Э (Н2О) = 1/2 моль, fЭ (О,Н2О) = ½; пЭ (О,Н2О) = 2 эквивалента (Э);
в) в соединении Al2О3 эквивалент оксида алюминия Э (Al2О3) = 1/6 моль, фактор эквивалентности fЭ (Al2О3) = 1/6, а число эквивалентов пЭ (Al2О3) = 6 Э; эквивалент алюминия Э (Al) = 1/3 моль, fЭ (Al) = 1/3, а пЭ (Al) = 3 Э.
6. При решении задач чаще всего используют понятие молярнаяэквивалентная масса (или кратко - эквивалентная масса) —это масса 1 моль эквивалентов вещества или атомов какого-либо элемента в химическом соединении, в граммах (МЭ, г/моль): МЭ = М × Э = М/ пЭ, = М. fЭ,
|
|
|
где М – молярная масса вещества (химического элемента), г/моль; Э – его эквивалент, моль; пЭ — число эквиалентов, fЭ — фактор эквивалентности.
7. Правила и формулы расчета молярных эквивалентных масс (МЭ)
для разных веществ:
7.1. Для простых одноатомных веществ и для одного химического элемента в сложном веществе: МЭ = М/п = А/п,
где А – атомная масса, n – валентность химического элемента.
Например, МЭ (Al) = 27/3 = 9 г /моль (эквивалентов), МЭ(О) = 16/2 = 8 г/моль;
7.2. Для простых многоатомных (из двух и более атомов) и сложных веществ эквивалентную массу рассчитывают по общей формуле МЭ = М/ п.k,
где М – молярная масса вещества, п – валентность одного, любого, элемента;
k – количество атомов этого элемента в молекуле.
Например, МЭ (О2) = 32/2.2 = 8, г /моль (эквивалентов), МЭ (N2) = 28/2.2 = 7, г /моль; МЭ (Al2О3) = (27.2 + 16.3)/3.2 = (54 + 48)/6 = 102/6 = 17, г/моль.
7.3. Эквивалентная масса сложного вещества равна сумме эквивалентных масс образующих его химических элементов.
Например, МЭ (Al2О3) = М (Al )/п (Al) + М (О )/п (О)= 27/3 + 16/2 = 17 г/моль. При этом fЭ (Al2О3)= МЭ (Al2О3)/ М (Al2О3)= 17 г/моль/102 г/моль = 1/6, Э (Al2О3)= 1/6 моль, чи сло эквивалентов пЭ (Al2О3) = 6 (6Э в 1 моле вещества Al2О3).
7.4. Для вычисления эквивалентных масс сложных веществ разных классов можно использовать следующие формулы (при условии полного замещения соответствующих функциональных групп или атомов, ионов, количество которых указано в формуле индексом; в противном случае, в реакциях неполного замещения, следует учитывать количество прореагировавших групп, атомов, ионов):
7.4.1. Эквивалентная масса оксида:
МЭ (окс) = М (окс) / k. п = М (окс.) / пЭ = М (окс). fЭ,
где М (окс) – молярная масса оксида, k – количество атомов какого-либо одного элемента в составе молекулы оксида, n – валентность этого элемента; пЭ — число эквивалентов, пЭ = k. п эквивалентов Э и fЭ — фактор эквивалентности оксида, fЭ = 1/ пЭ.
Например, МЭ (Мп2О7) = (55.2 + 16.7)/7.2 = 222/14 = 15,8 г/моль (эквивалентов).
7.4.2. Эквивалентная масса основания:
МЭ (осн)= М (осн) / k (ОН) = М (осн)/ пЭ,
где М (осн.) – молярная масса, k (ОН) – кислотность основания, т.е. количество гидроксидных групп ОН- в молекуле основания, равное числу эквивалентов пЭ в случае полного замещения групп ОН-; при неполном замещении, например, при недостатке кислоты, пЭ равно числу прореагировавших ОН--групп.
Например, МЭ (Са(ОН)2) = 74/2 = 37 г/моль – в случае полного замещения обеих групп ОН-, как в химической реакции: Са(ОН)2 + 2HCl = СаCl2 + 2Н2О.
При замещении одной ОН-–группы МЭ (Са(ОН)2) = 74/1 = 74 г/моль –
как, например, в реакции: Са(ОН)2 + HCl = СаОНCl + Н2О.
7.4.3. Эквивалентная масса кислоты:
МЭ (кисл) = М (кисл)/ k (Н)= М (кисл)/ пЭ,
где М (кисл) – молярная масса, k (Н) – основность кислоты, т.е. количество атомов Н в молекуле кислоты, равное числу эквивалентов пЭ кислоты при полном замещении атомов водорода; в случае их частичного замещения – например, при избытке кислоты – пЭ равно числу прореагировавших атомовН).
Например, МЭ(Н2SO4) = 98/2 = 49 г /моль, пЭ = 2Э (эквивалентам) – при полном замещении двух атомов водорода: 2NaCl + H2SO4 = Na2SO4 + 2HCl.
При недостатке соли (избытке кислоты) возможна реакция замещения только одного атома водорода: NaCl + H2SO4 = NaНSO4 + HCl,
и тогда МЭ(Н2SO4) = 98/1 = 98 г /моль, Э (Н2SO4) = 1 моль, пЭ = 1Э.
7.4.4. Эквивалентная масса соли:
МЭ (соли) = М (соли) / k. п,
где М (соли) – молярная масса соли,
k – количество атомов металла в молекуле соли, п – валентность металла.
Например, МЭ (Al2SO4)3) = 342/2. 3 = 57 г /моль.
7.5. Для определения эквивалента (эквивалентной массы) элемента необязательно исходить из его соединения с водородом. Достаточно знать состав соединения данного элемента с любым другим, эквивалентная масса (эквивалент) которого известна, поскольку - по закону эквивалентов.
7.6.Объем, занимаемый при данных условиях молярной эквивалентной массой газообразного вещества, т.е. 1 молем его эквивалентов, называется молярным эквивалентным объемом (или кратко - эквивалентным объемом) этого вещества, V Э (X) = VМ /k. п = VМ /пЭ(X),
где VМ - объем 1 моля любого газа при н.у., равный 22,4 л (л/моль);
k – количество атомов какого-либо одного элемента в молекуле газа X;
n – валентность этого элемента; пЭ(X) — число эквивалентов газа X (д ля молекулы любого газа, как и для оксидов, пЭ = k. п, эквивалентов (Э).
Например, для газообразных водорода и кислорода: V Э(Н 2) = 22,4/2. 1 = 11,2 л, пЭ = 2 эквивалента (Э), Э = ½ моля); V Э (О2) = 22,4/2. 2 = 5,6 л (пЭ = 4Э, Э = ¼ моля); для углекислого газа: VЭ(CО2) = 22,4/4. 1 = 5,6 л/моль (пЭ = 4 Э); для газа ацетилена: VЭ(C2Н2) = 22,4/4. 2 = 2,8 л/моль ( пЭ = 8 Э, Э = 1/8 моля).
3. Закон Авогадро (А. Авогадро, 1811):
В равных объемах различных газов при одинаковых условиях (давление, температура) содержится равное количество молекул: V1/ V2 = п1/п2 .
3.1. Закон Авогадро постулировал молекулярный состав газов. Известно только шесть газов атомарного строения в обычных, близких к стандартным, условиях – это благородные (или инертные, т.е. нереакционноспособные в таких условиях) газы, составляющие VIII A- подгруппу Периодической системы: гелий, неон, аргон, криптон, ксенон и радон.
3.2. В законе Авогадро, одном из основных законов идеальных газов и имеющем первостепенное значение для химии, нашел свое объяснение закон объемных отношений (Ж.-Л. Гей-Люссак, 1808): Объемы вступающих в реакцию газов при одинаковых давлении и температуре относятся друг к другу, а также к объемам образующихся газообразных продуктов как небольшие целые числа.
3.3. Из закона Авогадро выведено несколько важных следствий:
1. Один моль любого газа при одинаковых внешних условиях занимает один и тот же объем, называемый молярным объемом газа, VМ.
При нормальных условиях (273,1 К, 101,3 кПа) VМ = 22,4 л/моль.
2. В 1 моле любого газообразного вещества содержится одинаковое число м олекул, названное числом Авогадро, NA = 6,022ּ1023 моль –1.
В дальнейшем было установлено, что число Авогадро является фундаментальной физико-химической постоянной: это число структурных единиц - частиц (атомов, молекул, ионов, радикалов, электронов), составляющих 1 моль любого вещества в любом агрегатном состоянии.
3. Одинаковое число молекул различных газов при одинаковых внешних условиях занимает одинаковый объем: N1/ N2 = V1/ V2.
4. Массы равных объемов двух газов при одинаковых внешних условиях относятся друг к другу как их молярные массы: m1/m2=M1/ M2 .
Отношение массы определенного объема одного газа к массе такого же объема другого газа, взятых при одинаковых условиях, называют плотностью первого газа по второму, D2(1): D2(1) = m1/m2 .
Поскольку m1/m2=M1/ M2, тои М1/М2= D2(1).
Последнее соотношение имеет большое значение, т.к. позволяет определить молярную массу любого газа (М1) при известной плотности его по отношению к другому газу, умножив ее на молярную массу этого газа:
М1= М2 . D2(1).
Обычно плотность газа определяют по отношению к водороду (М(Н2) = 2,016 г/моль,) или воздуху (М(возд) = 29 г/моль - это значение считают средней молярной массой воздуха, т.к. воздух является смесью газов):
М1= 2,016. DН(1) или М1 = 29. DВОЗД,(1).
4. Закон идеального газового состояния (Менделеева–Клапейрона).
В условиях, отличных от нормальных, объем (V) любого известного количества (п) или массы (m) газа может быть рассчитан из уравнения Менделеева–Клапейрона — выражения объединенного (универсального) закона идеального газового состояния Менделеева–Клапейрона:
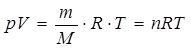 ,
,
отсюда V = m.R.T/ M. р = n.R.T/p,
где V – объем (л, дм3, 10-3 м3). р – давление (Па, атм., мм рт.ст.), Т — абсолютная температура (К), m – масса (г), М – молярная масса (г/моль), п= 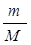 – количество (моль) газа;
– количество (моль) газа;
R – молярная газовая постоянная, R = 8,314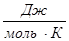 (кПа. л/(моль.К) или Па. м3 /(моль. К)); 0,082 атм. л/(моль. К); 62,34 л. мм рт.ст./(моль. К).
(кПа. л/(моль.К) или Па. м3 /(моль. К)); 0,082 атм. л/(моль. К); 62,34 л. мм рт.ст./(моль. К).
Закон Менделеева–Клапейрона называют объединенным (универсальным), т.к. он устанавливает общие для идеальных и разреженных реальных газов и важнейшие зависимости: а) объема и давления газа от температуры,
б) количеств разных газов и числа частиц в них от их объемов,- связывая частные газовые законы Бойля-Мариотта, Гей-Люссака, Шарля и Авогадро.
Лекция № 3
Тема: Периодический Закон и Система химических элементов Д.И.Менделеева.
Вопросы: 1.Структуры современных вариантов таблицы Периодической Системы.
2. ПС: история открытия, попытки классификации элементов до
Менделеева, причины неудач.
Самостятельная работа:
2. Варианты форм Периодической Системы.
Лекции №№ 4, 5
Тема: Строение вещества.
I. Строение атома.
Вопросы:
1. Доквантовые модели атома (Томсона, Резерфорда, Бора).
2. Современные теории строения атома:
- протонно-нейтронная,
- квантово-механическая.
3. Радиоактивность: понятие, виды, характеристики.
4. Закономерности заполнения электронных орбиталей атомов.
Электронные схема, формулы.
Самостятельная работа:
1. Первые (до Томсона) модели атома.
2. Спектры испусканния электронов в полупроводниках, светодиоды.
3. Радиоактивность: понятие, виды, характеристики.
Таблица 1. Характеристики основных элементарных частиц атома
____________________________________________________________________
Лекции №№ 6 - 10
Тема: Строение вещества
 2014-01-31
2014-01-31 702
702







