Реальные газы это любые объективно существующие газы, состояния молекул которых, позволяет им, свободно распространятся, по всему окружающему их пространству. Жидкости это совокупности молекул, соединения, которых не слишком прочны и подвержены деформациям. Твёрдые тела это материальные объекты, молекулярное или атомное строение которых, устанавливает прочные соединения между атомами.
Уравнение Ван-дер-Ваальса для одного моля газа (уравнение состояния реальных газов) 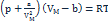 .
.
Если газ произвольной массы m занимает объем V, то его молярный объем 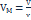 , где количество газа
, где количество газа 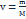 Подставив значение молярного объема, получим уравнение Ван-дер-Ваальса для произвольного числа ν молей газа:
Подставив значение молярного объема, получим уравнение Ван-дер-Ваальса для произвольного числа ν молей газа: 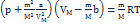 .
.
Постоянные для каждого газа поправки a и b находят экспериментально.
Так как молекулы идеального газа не имеют объема и не взаимодействуют между собой, то идеальный газ при любых изменениях его параметров остается газом.
Иначе говоря, состояние термодинамического равновесия определяется совокупностью внешних параметров и температуры.
|
|
|
Итак, все внутренние параметры равновесной системы являются функциями внешних параметров и температур.(Второй постулат термодинамики).
Выражая температуру через внешние параметры и энергию, второй постулат можно сформулировать в таком виде: при термодинамическом равновесии все внутренние параметры являются функциями внешних параметров и энергии.
Второй постулат позволяет определить изменение температуры тела по изменению какого либо его параметра, на чем основано устройство различных термометров.
 2018-02-14
2018-02-14 266
266








