Строение молекулы метана
В молекулах метана все четыре химические связи оказались одинаковыми, это объясняется гибридизацией.
Ø ГИБРИДИЗАЦИЯ - это смешение и выравнивание разных по форме и энергии электронных облаков.
В молекулах метана смешиванию и выравниванию подвергается одно шарообразное S-облако и три гантелеобразных P-облака. Такой вид гибридизации называется SP³-гибридизация(Рис.3.1).
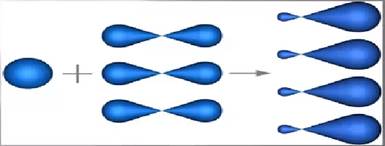
Рисунок3.1
SP³-гибридизация
В результате этого явления у атома углерода образуется четыре одинаковых по форме и энергии электронных облака, имеющих форму неправильной восьмерки. Такие облака получили название – ГИБРИДНЫЕ.
Каждое гибридное облако атома углерода перекрывается с шарообразным S-облаком атома водорода,в месте их перекрывания возникает химическая связь, которая получила названия сигма- связи.
H
| -СИГМА - СВЯЗЬ
 H ― C ―H ВЫВОД: все 4 химические связи в молекуле
H ― C ―H ВЫВОД: все 4 химические связи в молекуле
Н метана одинаковы и прочны
Тема 4:
Химические свойства метана.
1 свойство (горение метана).


Рисунок4.1 Рисунок4.2
Горение метана Горение метана
 CH4 + 2O2 CO2 + 2H2O + Q
CH4 + 2O2 CO2 + 2H2O + Q
Чтение уравнения:
(одна молекула метана вступает в реакцию с двумя молекулами кислорода с образованием одной молекулы углекислого газа и двух молекул воды).
Газ горит голубым пламенем, при взаимодействии с воздухом в отношении 1: 2 взрывается. Горит с образованием углекислого газа и воды – это горение полное. Экзотермическая реакция. Горение метана доказывает принадлежность его к органическим веществам(Рис.4.1,4.2).
2 свойство (замещение галогенами).
 1 этап CH4 + Cl2 CH3Cl + HCl
1 этап CH4 + Cl2 CH3Cl + HCl
хлорметан хлороводород
H H
| l
 H ― C ― H + Cl2 H ― C ― Cl + HCl
H ― C ― H + Cl2 H ― C ― Cl + HCl
| |
H H
 2 этап CH2 Cl + Cl2 CH2Cl2 + HCl
2 этап CH2 Cl + Cl2 CH2Cl2 + HCl
дихлорметан
H Cl
| |
 H ― C ― Cl + Cl2 H ― C ― Cl + HCl
H ― C ― Cl + Cl2 H ― C ― Cl + HCl
| |
H H

 3 этап CH2Cl2 + Cl2 CHCl 3 + HCl
3 этап CH2Cl2 + Cl2 CHCl 3 + HCl
трихлорметан
Cl Cl
| |
 H ― C ― Cl + Cl2 Cl ― C ― Cl + HCl
H ― C ― Cl + Cl2 Cl ― C ― Cl + HCl
| |
H H
 4 этап CHCl3 + Cl2 CCl 4 + HCl
4 этап CHCl3 + Cl2 CCl 4 + HCl
тетрахлорметан
Cl Cl
| |
 Cl ― C ― Cl + Cl2 Cl ― C ― Cl + HCl
Cl ― C ― Cl + Cl2 Cl ― C ― Cl + HCl
| |
 H C
H C
Чтение уравнений реакции (например) 1 этап: одна молекула метана вступает в реакцию с одной молекулой хлора с образованием одной молекулы хлорметана и одной молекулы хлороводорода.
Вывод: для алканов характерны реакции замещения и отсутствие реакции с сильными кислотами, сильными основаниями, с сильными окислителями, например, не обесцвечивают раствор перманганата калия (KMnO4). Это объясняется прочностью сигма – связи
Тема 5:
Номенклатура
Как назвать предельные углеводороды с разветвлённым строением по международной номенклатуре?
Задание:
Назвать по международной номенклатуре соединение (Табл.2):
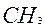
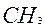
| |
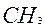 -
- 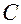 -
- 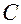 -
- 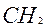 -
- 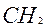 -
- 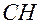 -
- 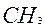
| | |
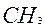
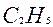
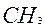
Таблица 2 Как назвать предельные углеводороды с разветвлённым строением по международной номенклатуре
| №№ пп | ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ | ВЫПОЛНЕНИЕ ДЕЙСТВИЙ |
| 1 | Выберете самую длинную углеродную«цепь», если имеются «свёрнутые» радикалы (боковые ответвления), то их следует развернуть. | 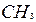 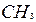 | |
| |
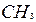 - - 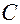 - - 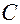 - - 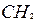 - - 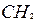 - - 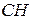 - - 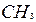 | | |
| | |
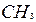 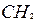 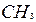 |
|
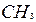
|
| 2 | Пронумеруйте атомыуглерода начиная с того конца цепи: а) где ближе разветвление б) ближе к которому имеется большеответвлений в) ближе к которому имеется более простой радикал | 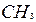 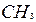 1 2 l 3 l 4 5 6 7
1 2 l 3 l 4 5 6 7
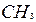 - - 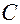 - - 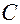 - - 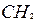 - - 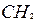 - - 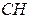 - - 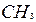 | | l
| | l
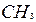 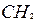 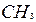 |
|
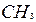
|
| 3 | Назовите радикалы (начиная с простейшего) и при помощи цифр укажите их место у пронумерованных атомов углерода. Если у одного и того же атома углерода находятся два одинаковых радикала, тогда номер повторите дважды.Количество одинаковых радикалов укажите при помощи чисел на греческом языке(ди -два, три-три, тетра- четыре и т.д.) | 2,2 2,2,3,6 – тетраметил- 3 этил … |
| 4 | Полное названиеданному углеводороду дайте по числу атомов углерода в пронумерованной цепи. | 2,2,3,6 – тетраметил – 3 этилгептан |
НОМЕНКЛАТУРА
Как составить структурную формулу предельного углеводорода разветвлённого строения по его названию (Табл.3).
Задание: составить структурную формулу 2,6 – диметил – 3 этилгептана
Таблица3 Как составить структурную формулу предельного углеводорода разветвлённого строения по его названию
| №№ п/п | Последовательность действий | Выполнение действий |
| 1 | Определите число атомов углерода по корню слова означающего название | (ГЕПТ) – означает – (СЕМЬ) |
| 2 | Установите характер химической связи в молекуле по окончанию слова обозначающего название вещества | (АН)- Свидетельствует об ординарных связях в молекуле |
| 3 | Напишите углеводородную цепь | C – C – C – C – C – C – C |
| 4 | Пронумеруйте атомы углерода | 1 2 3 4 5 6 7 C – C – C – C – C – C – C |
| 5 | Напишите радикалы к соответствующим атомам углерода в цепи | 1 2 3 4 5 6 7
C – C – C – C – C – C – C
| | |
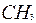 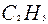 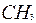
|
| 6 | Обеспечьте чёрточками недостающие валентности атома углерода |
| 1 | 2 | 3 | 4 | 5 | 6 | 7
– C – C – C – C – C – C – C –
| | | | | | |
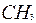 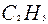 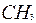
|
| 7 | Напишите у каждой (свободной) единицы валентности недостающие атомы водорода |
H H H H H H H
| | | | | | |
H – C – C – C – C – C – C – C – H
| | | | | | |
H 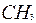 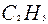 H H H H 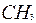 H H
|
| 8 | Замените полную структурную формулу сокращённой |
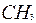 - - 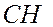 - - 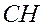 - - 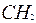 - - 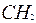 - - 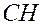 - - 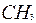 | | |
| | |
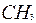 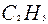 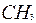
|
Тема 6:
 2020-04-07
2020-04-07 383
383








