Задания для выполнения лабораторной работы (можно не конспектировать)
1. Микроскопировать и зарисовать мазки из чистых культур возбудителей кишечных инфекций.
2. Диагностика брюшного тифа и паратифов.
2.1. Бактериологическая диагностика:
а) выбрать материал для исследования;
б) учесть результаты первичного посева исследуемого материала на среду Раппопорт;
в) учесть результаты пересева бактерий со среды Раппопорт на среду Эндо. Описать и зарисовать колонии, выросшие на среде Эндо, и обосновать выбор подозрительных колоний для дальнейшего исследования;
г) учесть результаты пересева подозрительных колоний со среды Эндо на среду Ресселя;
д) учесть результаты идентификации выделенной чистой культуры по биохимическим свойствам;
е) сделать вывод и наметить план дальнейшего исследования.
2.2. Серодиагностика. Проанализировать результаты реакции Видаля.
3. Бактериологическая диагностика сальмонеллезов:
а) выбрать материал для исследования;
б) учесть результаты первичного посева исследуемого материала на висмут-сульфит агар. Описать и зарисовать колонии и обосновать выбор подозрительных колоний для дальнейшего исследования;
в) учесть результаты пересева подозрительных колоний на среду Ресселя;
г) учесть результаты идентификации выделенной чистой культуры по биохимическим свойствам;
д) сделать вывод и наметить план дальнейшего исследования.
4. Ознакомиться с диагностическими и лечебно-профилактическими препаратами.
Методические указания
Микробиологическая диагностика брюшного тифа и паратифов
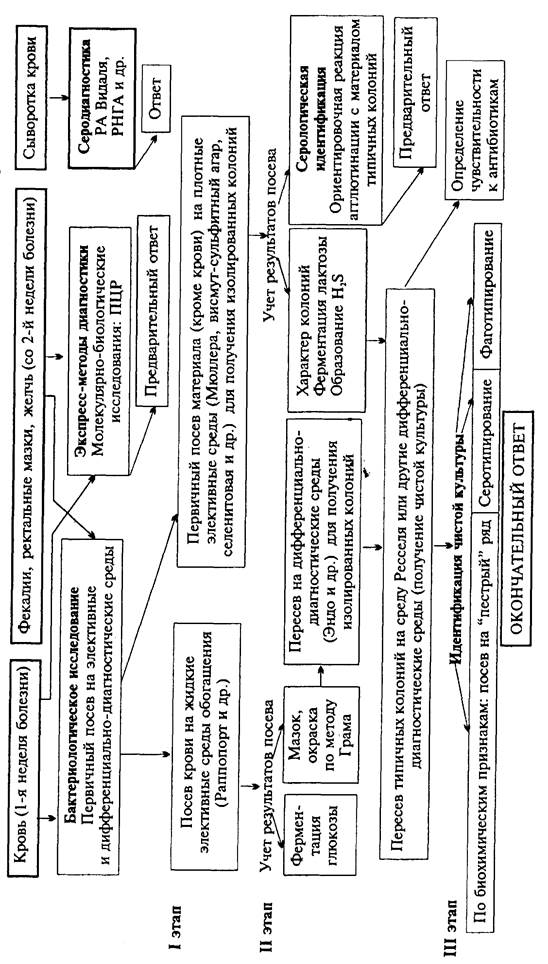
Материал для исследования: исходя из особенностей патогенеза брюшного тифа, на 1-й неделе заболевания, в период бактериемии, возбудителей выделяют из крови (получение гемокультуры), со 2-й недели заболевания - из испражнений (получение копрокультуры), мочи или желчи. Антитела в сыворотке накапливаются при брюшном тифе в конце 1-й недели заболевания.
Бактериологическое исследование (схема 6).
Получение гемокультуры. В 1-й день из локтевой вены больного берут 5-10 мл крови и засевают в колбу с 50-100 мл селективной среды Раппопорт, содержащей желчный бульон (для подавления роста других бактерий), глюкозу, индикатор Андреде и поплавок для обнаружения газа. Указанные соотношения крови и среды необходимы для подавления бактерицидного действия белков крови. Посевы инкубируют при 37 °С в течение 18-20 ч. На 2-й день при росте сальмонелл наблюдается помутнение и изменение цвета среды. При росте паратифозных бактерий (биовары раratyphi А, С и schotmulleri) наряду с указанными изменениями появляются пузырьки газа в поплавке. Для ускорения ответа из среды Раппопорт делают мазки и препараты "висячая" капля. При наличии чистой культуры грамотрицательных подвижных палочек и изменении цвета среды (или наличии газа) дают первый предварительный ответ. Затем культуру из среды Раппопорт пересевают в пробирку со средой Ресселя, полагая при этом, что из крови выделена чистая культура и можно сразу приступить к ее идентификации. Одновременно со среды Раппопорт делают посевы на среду Эндо для получения изолированных колоний с целью проверки чистоты выделенной культуры.
Схема 6. Микробиологическое исследование при брюшном тифе и паратифе
|
На 3-й день отмечают ферментацию глюкозы на среде Ресселя и ставят ориентировочную реакцию агглютинации на стекле. На основании полученных данных дают второй предварительный ответ. Для дальнейшего исследования отбирают несколько бесцветных колоний со среды Эндо и пересевают их в среду Ресселя или скошенный питательный агар (для контроля полученных результатов). Чистую культуру пересевают на среды "пестрого" ряда и серотипируют в реакции агглютинации на стекле со смесью групповых сывороток, а затем с адсорбированными монорецепторными О- и Н-сальмонеллезными сыворотками. Окончательный диагноз устанавливают на основании биохимических (табл. 5) и антигенных свойств. Биохимические признаки (развернутый "пестрый" ряд) позволяют дифференцировать сальмонеллы от схожих с ними энтеробактерий: Citrobacter, Hafnia (табл. 6).
Выделенную чистую культуру бактерий используют для определения чувствительности к антимикробным препаратам.
Таблица 5. Биохимические свойства сальмонелл - возбудителей брюшного тифа и паратифов
| Биовар S. епtеriса | Ферментация | Образование | ||||||
| лактозы | глюкозы | мальтозы | сахарозы | маннита | H2S | NH3 | индола | |
| typhi | - | К | К | - | К | + | - | - |
| раratyphi А | - | КГ | КГ | - | КГ | - | - | - |
| schotmulleri | - | КГ | КГ | - | КГ | + | + | - |
Условные обозначения: (К) - образование кислоты; (КГ) - образование кислоты и газа; (+) - обнаружение признака; (-) - отсутствие признака.
Таблица 6. Дифференциация сальмонелл и других энтеробактерий по биохимическим признакам
|
Род | Лизин-декар-бокси-лаза | Ферментация углеводов | b-Галак-този-даза | |||||
| дуль-цита | сор-бита | кси-лозы | рам-нозы | сали-цина | 4% лактозы | |||
| Salmonella | +- | К(-) | К | К | К | - | - | - |
| Citrobacter | - | К(-) | К | К | К | К(+-) | К(+-) | К |
| Hafnia | + | - | - | К | К | К(+-) | - | К |
Условные обозначения: (+) - положительная реакция; (-) - отрицательная реакция; (+-) - вариабельная реакция; К - образование кислоты; К(-) - образование кислоты (редко); К(+-) - образование кислоты (вариабельно).
Фаготипирование. С помощью набора стандартных Vi- фагов определяют до 78 фаготипов S. enterica биовара tурhi. При этом необходимым условием является наличие в культуре Vi- антигена. Культуры S. enterica биовара раratyphi В (schotmulleri) дифференцируются на 11 фаготипов и подтипов.
Получение копрокультуры. Испражнения засевают на одну из дифференциально-диагностических сред (Эндо или Левина) или элективные среды обогащения (Мюллера, селенитовая или висмут-сульфит агар). Для посева петлю фекалий вносят в пробирку с изотоническим раствором хлорида натрия и готовят суспензию. После оседания крупных комочков суспензию петлей наносят на поверхность агаровой среды - на одну половину чашки. Материал тщательно растирают шпателем по одной, а затем по другой половине чашки для получения изолированных колоний. Посевы инкубируют при 37 °С в течение 18-20 ч. На 2-й день изучают характер колоний, выросших на чашках, пересевают 2-3 бесцветные колонии (со среды Эндо или Левина) или колонии черного цвета (висмут-сульфит агар) на среду Ресселя и в пробирки со скошенным питательным агаром. При отсутствии подозрительных колоний на чашках делают высевы из среды Мюллера или селенитовой среды на чашки со средой Эндо для получения изолированных колоний. Для ускорения ответа ставят ориентировочную реакцию агглютинации на стекле с материалом, взятым из бесцветной колонии. Далее поступают так же, как и при идентификации гемокультуры.
Экспресс-методы диагностики. Материал, полученный из очага инфекции, в молекулярно-биологических исследованиях используют для обнаружения ДНК возбудителя с помощью ПЦР.
Серодиагностика. В лабораторной практике широко применяют развернутую реакцию агглютинации Видаля, основанную на обнаружении в сыворотке крови людей антител - агглютининов, которые появляются в конце 1-й - начале 2-й недели заболевания. Реакцию ставят одновременно с четырьмя антигенами: О- и Н-брюшнотифозными, А- и В-паратифозными диагностикумами. Брюшнотифозные монодиагностикумы применяют для установления стадии болезни, так как содержание О- и Н-антител в разные ее периоды неодинаково, О-антитела появляются на 1-й неделе, накапливаются в разгар заболевания и исчезают к моменту выздоровления. Н-антитела появляются в разгар заболевания, накапливаются к концу заболевания и сохраняются у переболевших в течение длительного времени. У людей, вакцинированных против брюшного тифа и паратифов, также наблюдается положительная реакция Видаля, причем в довольно высоком титре, поэтому "инфекционный Видаль" удается отличить от "прививочного" только по нарастанию титра агглютининов у больных в процессе заболевания. Реакцию Видаля ставят в четырех рядах пробирок по 7 пробирок в каждом ряду, из которых 5 опытных и 2 контрольные. Для контроля каждого диагностикума в пробирки вносят по 1 мл изотонического раствора хлорида натрия, в который добавляют 2 капли диагностикума. В контрольной пробирке с 1 мл сыворотки (без диагностикума) не должно быть хлопьев. При спонтанной агглютинации реакция не учитывается. Диагностический титр реакции Видаля равен 1:200. Для серологического исследования реконвалесцентов и выявления бактерионосителей широко используют реакцию непрямой Vi -гемагглютинации, с помощью которой в сыворотке крови людей определяют присутствие антител к Vi -антигену. В качестве антигена используют эритроцитарный Vi -диагностикум, представляющий собой взвесь эритроцитов человека I(0) группы, обработанных формалином и сенсибилизированных Vi -антигеном S. enterica биовара typhi. Готовят разведения испытуемой сыворотки от 1:10 до 1:1280. При положительной реакции эритроциты покрывают дно пробирки в виде диска с зазубренными краями, а надосадочная жидкость остается прозрачной. При отрицательной реакции, так же как и в контроле, эритроциты осаждаются на дно пробирки и имеют вид диска с ровными краями ("пуговки"). Диагностическое значение имеет титр пассивной Vi -гемагглютинации, начиная с 1:40 и выше. Всех лиц, сыворотка крови у которых дает положительный результат в РНГА с эритроцитарным Vi -диагностикумом, рассматривают как подозрительных на носительство S. enterica биовара typhi и подвергают многократному бактериологическому обследованию.
 2020-05-21
2020-05-21 119
119







