Железо – металл средней активности. Сложность написания реакций связано с наличием у железа двух достаточно устойчивых степеней окисления +2 и +3. Рассмотрим на примерах.
1. Взаимодействие с неметаллами.
С кислородом. Раскаленная железная проволока горит в кислороде с образованием железной окалины:
3Fe + 2O2 = Fe+2Fe+32O4
C галогенами. Фтор, хлор и бром – сильные окислители, железо окисляется до степени окисления +3, например:
2Fe + 3Cl2 = 2FeCl3
Отметим, что при растворении железа в соляной кислоте образуется хлорид железа(II) (в этой реакции железо окисляется менее сильным окислителем H+):
Fe + 2HCl = FeCl2 + H2
С менее сильными окислителями – йодом и серой др., железо окисляется до степени окисления +2, например:
Fe + S  FeS
FeS
При высокой температуре железо реагирует с углеродом и фосфором, образуются соединения Fe3C и Fe3P.
2. Взаимодействие со сложными веществами.
С водой. С водяным паром при высоких температурах протекает реакция:
3Fe + 4H2O = Fe+2Fe+32O4+ 4H2
Во влажном воздухе и в воде железо подвергается коррозии, ржавеет:
|
|
|
4Fe + 3O2 + 6H2O = 4Fe(OH)3
Следует отметить, что элементы триады железа – кобальт и никель – коррозии не подвержены, добавки этих металлов делают сталь «нержавеющей».
С кислотами-неокислителями, с растворами солей, реагирует как типичный металл средней активности. Без нагревания железо (как и алюминий) не реагирует с концентрированными азотной и серной кислотой из-за эффекта пассивации. При нагревании легко окисляется этими кислотами (см. раздел ОВР).
3. Железо при нагревании реагирует с угарным газом с образованием карбонила железа:
Fе + 5CO = [Fе(CO)5]
4. При высоких температурах в реакциях с сильными окислителями (KClO3, KNO3) железо окисляется до степени окисления +6, образуются ферраты, например:
Fе + KClO3 + 2KОН = K2FeO4 + KCl + Н2O
Железо при нагревании реагирует с соединениями железа(III), надо знать реакции:
Fе + Fe2O3  3FeO
3FeO
Fе + Fe2(SO4)3  3FeSO4
3FeSO4
Соединения железа
Существуют два гидроксида железа: основание Fe(ОН)2 бледно-зеленого цвета и проявляющий слабые амфотерные свойства гидроксид Fe(ОН)3 бурого цвета. Свежеосажденный Fe(ОН)2 достаточно быстро окисляется кислородом по реакции:
2Fe(ОН)2 + 0,5 O2 + Н2O = 2Fe(ОН)3
Fe(ОН)3 проявляет амфотерность только в концентрированных растворах щелочей:
Fe(ОН)3 + 3KОН = Na3[Fe(ОН)6]
При низких температурах более устойчивыми являются соединения железа(III), при высоких – железа(II), на переходе Fe+3 + ē «Fe+2 основано множество ОВР. Здесь рассмотрим некоторые наиболее сложные:
6FeSO4 + 4Н2SO4 + 2KNO3 = 3Fe2(SO4)3 + 2NO + K2SO4 + 4Н2O
4Fe(NO3)2 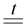 2Fe2O3 + 8NO2 + O2
2Fe2O3 + 8NO2 + O2
2FeCl3 + 3(NН4)2S = 2FeS¯ + 6NН4Cl + S¯
|
|
|
2FeCl3 + 2Hg = 2FeCl2 + Hg2Cl2
 2020-05-25
2020-05-25 120
120








