| Группа | № урока | Тема | Форма работы |
| СПК-1 | 59 | Получение коллоидных систем | Лекция |
| 60 | Получение коллоидных систем | Составить краткий конспект. |
Получение коллоидных систем
Золи по размеру частиц занимают промежуточное место между истинными растворами и микрогетерогенными системами. Поэтому их можно получить сочетанием отдельных молекул или ионов, а также диспергированием грубодисперсных частиц.
Образование коллоидных систем состоит из следующих этапов:
1. получение частиц дисперсной фазы коллоидной дисперсности диспергированием частиц грубой дисперсности;
2. подбор дисперсионной среды, в которой дисперсная фаза нерастворима или очень мало растворима;
3. подбор и введение стабилизатора, обеспечивающего устойчивость коллоидных систем.
По предложению Сведберга, методы получения коллоидных систем делятся на две группы — диспергационные и конденсационные. Особое место занимает метод пептизации, заключающийся в переводе в коллоидный раствор осадков, первичные частицы которых имеют коллоидные размеры.
Методы диспергирования.
Диспергированием называют такое измельчение твердых или жидких тел в данной среде, при котором резко повышается дисперсность и образуется дисперсная система, обладающая значительной удельной межфазной поверхностью. Диспергирование происходит с затратой внешней работы, необходимой для преодоления молекулярных сил диспергируемого вещества. Энергия, затрачиваемая на диспергирование единицы объема, пропорциональна удельной поверхности или дисперсности продукта диспергирования.
Установлено, что на поверхности диспергируемого вещества развиваются микрощели; поглощенные вещества проникают в устья образующихся микрощелей и стремятся раздвинуть каждую микрощель, что способствует диспергированию. Облегчение диспергирования под влиянием адсорбции названо адсорбционным понижением прочности твердых тел (эффект Ребиндера). Вещества, повышающие эффективность диспергирования, называют понизителями прочности твердых тел. Основу адсорбционного понижения прочности твердого тела составляет уменьшение свободной энергии как на внешней поверхности твердого тела, так и на внутренних поверхностях микрощелей. Это и приводит к размягчению твердого тела.
Жидкость, попадая в микрощели, обладает квазиупругими (от лат. quasi — якобы) свойствами, образуя пленки толщиной до 1 мкм. Эти пленки производят дополнительное расклинивающее действие.
Методы диспергирования принято делить на четыре вида:
1. механическое диспергирование применяется при изготовлении муки, сахарной пудры, порошка какао и т.п.;
2. электрическое диспергирование основано на явлении, установленном в 1883 г. В. Тихомировым и А. Лидовым, и заключается в сильном диспергировании двух кусков металла, погруженных в жидкость, с образованием между ними вольтовой дуги. При этом образуется исключительно мелкая пыль;
3. термическое диспергирование основано на конденсации паров металла. Метод предложен С.З. Рогинским и А.И. Шальниковым. На его основе разработан производственный способ получения органозолей (золей с органической дисперсионной средой) щелочных металлов;
- химическое диспергирование состоит в превращении геля в золь. В качестве примера можно рассмотреть превращение рыхлого осадка гидроксида железа Fe(OH)3 в гидрозоль. Для этого на холоде осаждают гидроксид железа, добавляя раствор 2 H.FeCl3 (содержащий 10 г соли в 100 мл раствора) в небольшой избыток аммиака
(но не в обратном порядке). Полученный осадок промывают холодной водой 2—3 раза. К промытому гидроксиду добавляют концентрированный раствор 4—8 H.FeCl3 и слегка взбалтывают содержимое сосуда. Через некоторое время осадок как бы растворяется и получается жидкость коричневого цвета — гидрозоль гидроксида железа. Если теперь к нагретому раствору FeCl3 добавлять небольшими порциями только часть эквивалентного количества аммиака, то получится гидрозоль Fe(OH)3 темно-красного цвета.
Метод конденсации состоит в соединении простых молекул, атомов и ионов с образованием комплексов коллоидной степени дисперсности. При этом уменьшается запас потенциальной энергии самой системы. Следовательно, процесс конденсации протекает самопроизвольно и с энергетической точки зрения он выгоднее метода диспергирования.
Методы конденсации делятся на две группы: физические и химические.
Один из методов физической конденсации — метод замены растворителя. Он основан на изменении среды, при переходе в которую растворимое ранее вещество становится нерастворимым или малорастворимым. Так, сера растворяется в этиловом спирте с образованием истинного раствора, а в воде сера нерастворима, поэтому при добавлении воды к спиртовому раствору серы молекулы конденсируются в более крупные агрегаты с образованием устойчивого золя серы.
При химической конденсации применяются реакции — окислительно-восстановительные, двойного обмена, гидролиза и т.п. Общая черта всех методов химической конденсации заключается в приготовлении молекулярно-дисперсного пересыщенного раствора, из которого должны быть получены золи. Способ, которым достигается пересыщение, зависит только от вещества, подвергающегося воздействию. Обычно пересыщенный раствор получается в результате химической реакции. Например, золь серы получают:
О при подкислении натрия тиосульфата
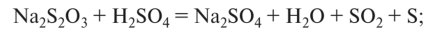
О при окислении сероводородной воды кислородом воздуха 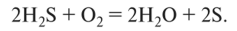
Золи драгоценных металлов обычно получают восстановлением раствора соответствующей соли фосфором или другими восстановителями. Золь серебра получают восстановлением суспензии оксида серебра водородом.
Процесс восстановления ионов и конденсация металла протекают почти одновременно и представляют сложный процесс возникновения зародышей твердой металлической фазы и их роста. Например, коллоидное серебро можно получить восстановлением оксида серебра декстрином. При этом роль декстрина заключается еще и в удержании роста кристаллов серебра на стадии коллоидной степени дисперсности, в результате чего получается высокостабильный золь серебра. Последний можно выявить по специфической окраске, свойственной вообще всем коллоидным растворам. Так, золь серебра имеет зеленую окраску в отраженном свете и коричнево-красную — в проходящем.
Существенное значение при получении коллоидных систем имеет концентрация растворов реагирующих веществ. Это можно проследить на примере реакции образования берлинской лазури
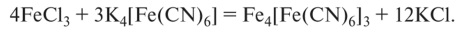
При быстром смешении эквивалентных количеств концентрированных растворов FeCl3 и K4[Fe(CN)6] образуется густой гель берлинской лазури. При взаимодействии растворов этих же солей, но разбавленных в 10 раз, образуется осадок берлинской лазури. Если растворы этих солей разбавить очень сильно и затем смешать, то получится устойчивый золь берлинской лазури.
 2020-06-08
2020-06-08 109
109






