Синтез MnO(OH).
В большом химическом стакане растворила 4,46г MnSO4*4H2O в 90 мл воде. Потом прибавила 68 мл 3 % – ного раствора H2O2, а затем при температуре раствора 200C и при очень сильном перемишивании добавила 120 мл разбавленный раствор аммиака.
Выделяющую кислород темную коричнево-черную суспензию нагрела 4 мин. тотчас же после приливания раствора аммиака. После этого отфильтровала раствор. Получила MnO(OH). При осторожном обезвоживании 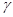 - MnO(OH) в вакууме при 2500С можно получить
- MnO(OH) в вакууме при 2500С можно получить 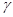 -Mn2O3.
-Mn2O3.
2MnSO4*4H2O+H2O2+4NH3à2MnO(OH)+2 (NH4)2SO4+6H2O
оксогидроксид триоксалатоманганат диоксалатодиакваманганат
Синтез K3 [Mn(C2O4) 3]*3H2O.
Я использовала MnO(OH), H2C2O4, K2C2O4 для получения триоксолатоманганат (III) калия. Я взяла 0.75 г. H2C2O4 и 0.75 г. K2C2O4 и каждый растворила в 6 мл воды. Дальше смешала растворы этих двух соединений и добавила к ним 0.5 г. MnO(OH). Образовалась смесь красно-фиолетового цвета. Отфильтровала через воронку Бюхнера и увидела получившиеся кристаллы K3 [Mn(C2O4) 3]*3H2O.
Получение K [Mn(C2O4)2(H2O)2]
Для получения этого комплекса мы повторим путь синтеза MnO(OH), и K3[Mn(C2O4)3]*3H2O. Только в случае, когда образовался последний комплекс, при отфильтрованиа осадка K3[Mn(C2O4)3]*3H2O мы специально добавили дистиллированной воды, с тем чтобы быстро произошло реакция:
K3[Mn(C2O4)3]*3H2Oà K [Mn(C2O4)2(H2O)2] + K2C2O4 + H2O(раствор)
K3[Mn(C2O4)3]*3H2Oàкрасно-фиолетовый
K [Mn(C2O4)2(H2O)2]à желто-коричневый
Две молекулы воды при этом входят во внутреннюю координационную сферу и молекулы воды уводят K2C2O4 из реакционной зоны т. е. Последняя часть синтеза произошла в воронке со стеклянным пористым дном. В результате получился желто-коричневый осадок (цвет характерен для K [Mn(C2O4)2(H2O)2]). Осадок окончательно отфильтровали на этой воронке, высушили на фильтровальной бумаге на воздухе. Ясно, что во всех операциях мы не проводим затемнения стаканов, сосудов, воронки.
В доступный литературе мы не нашли сведений об устойчивости манганатов (III). Но можно предложить, что комплекс, содержащий воду во внутренней координационной среде, будет устойчивее, поскольку в стехиометрическом ряду лигандов H2O стоит правее чем C2O42-
Cl-<F-<C2O42-<H2O<NH3<CN-
Список литературы
1. Брауэр. Руководство по неорганическому синтезу. М.: Мир. 1985. Т. 5. с. 1684, 1694–1695.
2. Ю.Д. Третьяков, Л.И. Мартыненко, А.Н. Григорьев, А.Ю. Цивадзе. Неорганическая Химия. Химия элементов. Том 1. с. 4/0.
3. М.Е. Тамм, Ю.Д. Третьяков. Неорганическая химия в трех томах. Том 1. Физико-химические основы неорганической химии. 2004. с. 189–195.
Размещено на
 2020-09-24
2020-09-24 96
96







