Рассмотрим атом в невозбужденном состоянии. Состояние каждого электрона этой системы описывается квантовыми числами  ,
,  ,
,  и
и  .
.
Электроны в атомах распределяются по состояниям в определенном порядке в соответствии с принципом Паули, т.е. в каждом состоянии может находиться не более одной частицы с полуцелым спином.
Энергия электрона определяется главным образом числами  и
и  (от взаимной ориентации моментов
(от взаимной ориентации моментов  и
и  , т.е. от квантовых чисел
, т.е. от квантовых чисел  и
и  , энергия электрона зависит значительно слабее). Совокупность электронов с одинаковым
, энергия электрона зависит значительно слабее). Совокупность электронов с одинаковым  образует оболочку (оболочки принято обозначать буквами
образует оболочку (оболочки принято обозначать буквами  ,
,  ,
,  ,
,  ,
,  и т.д.). Число электронных состояний (уровней) в оболочке с учетом спина равно кратности вырождения, т.е. равно
и т.д.). Число электронных состояний (уровней) в оболочке с учетом спина равно кратности вырождения, т.е. равно  . Оболочки подразделяются на подоболочки, отличающиеся значением числа
. Оболочки подразделяются на подоболочки, отличающиеся значением числа  .
.
Как же заполняются электронные оболочки атомов?
 (
( -оболочка);
-оболочка);  (
( -состояние);
-состояние);  ;
;  2 электрона; форма облака – сфера.
2 электрона; форма облака – сфера.
 (
( -оболочка);
-оболочка);
 (
( -состояние);
-состояние);  ;
; 
 (
( -состояние);
-состояние);  ;
;  8 электронов
8 электронов
 ;
; 
 ;
; 
форма облака – 3 гантели, ориентированные в 3-х взаимноперпендикулярных направлениях.
|
|
|
 (
( -оболочка);
-оболочка);
 (
( -состояние);
-состояние);  ;
; 
 (
( -состояние);
-состояние);  ;
;  8 электронов
8 электронов
 ;
; 
 ;
; 
 (
( -состояние);
-состояние);  ;
; 
 ;
; 
 ;
;  18 электронов
18 электронов
 ;
; 
 ;
; 
Символы  наглядно обозначают
наглядно обозначают  .
.
Полностью заполненные оболочки и подоболочки имеют  ,
,  и
и  .
.
Например,  -подоболочка:
-подоболочка:  и это единственное значение, поэтому
и это единственное значение, поэтому  , также
, также  (т.к.
(т.к.  ), следовательно,
), следовательно,  .
.
Это важный результат: при определенных квантовых числах  и
и  атома заполненные оболочки можно не принимать во внимание. Оболочки (или подоболочки), полностью заполненные электронами, называют замкнутыми. Основным термом замкнутых оболочек (подоболочек) является
атома заполненные оболочки можно не принимать во внимание. Оболочки (или подоболочки), полностью заполненные электронами, называют замкнутыми. Основным термом замкнутых оболочек (подоболочек) является  .
.
Закономерность заполнения электронных оболочек в атомах соответствует периодической системе элементов Менделеева.
Если происходит заполнение только  -оболочки – это I период (H, He), заполнение
-оболочки – это I период (H, He), заполнение  - и
- и  -оболочкек – II период (от Li до Ne), заполнение
-оболочкек – II период (от Li до Ne), заполнение  -,
-,  - и
- и  -оболочки – III период (от Na до Ar,
-оболочки – III период (от Na до Ar,  - и
- и  - состояния).
- состояния).
Каждый следующий атом получается из предыдущего добавлением одного электрона, который помещают в разрешенное принципом Паули состояние.
Распределение электронов в атоме называется электронной конфигурацией. Например, электронная конфигурация Na -  . Здесь полностью заполнены
. Здесь полностью заполнены  - и
- и  -оболочки. Электрон в
-оболочки. Электрон в  - состоянии является валентным. Терм атома натрия в основном состоянии
- состоянии является валентным. Терм атома натрия в основном состоянии  . Следует отметить, что наблюдаемая периодичность химических и ряда физических свойств объясняется поведением именно внешних, валентных электронов.
. Следует отметить, что наблюдаемая периодичность химических и ряда физических свойств объясняется поведением именно внешних, валентных электронов.
До IV периода заполнение оболочек и подоболочек имеет «идеальный» характер. В четвертом периоде дальнейшее заполнение электронных оболочек происходит не за счет заполнения  - состояния
- состояния  - оболочки, а за счет заполнения
- оболочки, а за счет заполнения  - состояния
- состояния 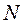 -оболочки. Это происходит из-за того, что уровень
-оболочки. Это происходит из-за того, что уровень  оказывается выше, чем уровень
оказывается выше, чем уровень  . Такая конфигурация является энергетически более выгодной. Причина - экранировка ядра атома внутренними электронами. Влияние экранировки тем больше, чем больше число электронов в атоме.
. Такая конфигурация является энергетически более выгодной. Причина - экранировка ядра атома внутренними электронами. Влияние экранировки тем больше, чем больше число электронов в атоме.
|
|
|
Термы основных состояний атомов определяются состояниями валентных электронов.
Термы первых четырех элементов можно легко определить – для этого достаточно принципа Паули:
для водорода -  ,
,
для гелия -  ,
,
для лития -  ,
,
для берилия -  .
.
У бора  пятый электрон занимает одно из
пятый электрон занимает одно из  -состояний (
-состояний ( ,
,  ,
,  или
или  ) – термы соответствующих состояний
) – термы соответствующих состояний  и
и  . Какой из этих термов соответствует основному состоянию атома? Ответить на этот вопрос
. Какой из этих термов соответствует основному состоянию атома? Ответить на этот вопрос
позволяют полуэмпирические правила Хунда:
1) из термов, принадлежащих данной электронной конфигурации наименьшей энергией обладает терм с наибольшим квантовым числом  и наибольшим возможным при данном
и наибольшим возможным при данном  числом
числом  ;
;
2) при этом полное квантовое число атома принимает значение  , если подоболочка заполнена меньше, чем наполовину, в остальных случаях
, если подоболочка заполнена меньше, чем наполовину, в остальных случаях  .
.
Минимальной энергии соответствуют состояния с наибольшим значением суммарного спина, а среди них наименьшим будет уровень с наибольшим орбитальным моментом.
 2020-10-12
2020-10-12 139
139







