Если пар, находящийся в ёмкости под давлением продолжать сжимать, то через некоторое время он становится насыщенным. При дальнейшем повышении давления будет происходить конденсация пара и вследствие этого уменьшение его объёма. Когда весь пар перейдет в жидкость, то при дальнейшем повышении давления эта жидкость будет сжиматься на такую ничтожную величину, что ею часто можно пренебречь. Следовательно, повышение давления способствует конденсации. Снижение же давления, наоборот, - испарению. Это - прямые процессы.
Явления обратной конденсации и испарения
Но в зоне высоких давлений и при других определенных условиях происходят обратные процессы, т.е. при повышении давления происходят испарение, а при понижении давления - конденсация. Такие процессы называют обратными.
Месторождения, образовавшиеся в результате таких обратных процессов, называются газоконденсатными. Существование газоконденсатных месторождений объясняется тем, что углеводородные смеси при давлении, начиная с 3,0 - 4,0 МПа, перестают подчиняться законам упругости паров и равновесных соотношений.
|
|
|
Константы равновесия углеводородов с ростом давления также возрастают, т. е. жидкости становятся более летучими. В результате смесь может оказаться в газообразном состоянии. Все это происходит при температуре выше критической. Практическое же значение имеет явление обратной конденсации и испарения при давлении обычно более 15,0 МПа.
Рассмотрим диаграмму фазовых состояний одного вещества (рис 8)
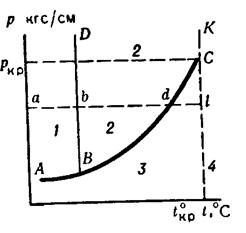
Рисунок 8 - Диаграмма зависимости давления и температуры для индивидуального компонента:
1 – твердое состояние;
2 – жидкое состояние;
3 – парообразное состояние;
4 – газообразное состояние.
Здесь АВ - граница твердого состояния и пара (линия сублимации); BD - граница твердого и жидкого состояний (линия плавления); ВС - линия жидкого и парообразного состояний (линия испарения), точка С - критическая. При достижении температуры в этой точке исчезает граница между жидким и газообразным состояниями вещества. Выше такой температуры вещество представляет собой газ, который не превращается в жидкость при любом давлении. В точке В (тройной) при строго определенных параметрах существуют все три фазы.
Из диаграммы видно, что в интервале ab, т. е. в области твердого состояния вещества, данному давлению соответствуют ряд значений температур и изменяющийся удельный объём. В интервале bd, т. е. в области жидкой фазы, то же самое. В точке d давления, т.е. в зоне существования двух фаз может быть свободно выбран только один параметр. Между точками d и l существует одна паровая фаза. Начиная от точки l и далее, т. е. выше критической температуры, вещество находится в газообразном состоянии. В крайней точке С кривой ВС температура критическая, до которой возможно существование жидкой фазы данного вещества. Выше этой точки существует только чисто газовая фаза данного вещества. Этой критической температуре соответствует определенное критическое давление Ркр являющееся вторичным параметром критического состояния вещества.
|
|
|
Вертикальная линия СК, соответствующая критической температуре tкр является границей перехода вещества из одного состояния в другое; линия КС - скачкообразного перехода из жидкого состояния в газообразное, точка С - перехода из парообразного состояния в газообразное.
При условиях, близких к tкр, сглаживается разница в физических свойствах жидкости и пара, исчезающая при критической температуре.
Рассмотрим диаграмму для двухкомпонентной системы (рис. 9.). В области, расположенной выше температуры, соответствующей точке СR, существование жидкой фазы данной смеси невозможно. Точку СR, обычно называют точкой критической температуры конденсации, а точку СХ - критической температурой многокомпонентной смеси. Обычно в этой точке в двухфазное состояние из этой смеси переходит примерно 50 % жидкости. Для чистого же компонента в точке СR, состояние жидкой фазы предельное. Выше этой точки жидкость переходит в пар. Этим различаются критические температуры смеси и чистого компонента.
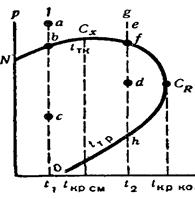
Рисунок 9. Диаграмма давления и температуры для двух компонентой системы:
tкр – кривая точек кипения;
tтр – кривая точек росы.
Рассмотрим два варианта изменения состояния смеси со снижением давления: первый - при температуре ниже критической в точке СХ, а второй - выше нее, но ниже СR.
Изменение состояния смеси по линии abc при температуре t1< tкр.см. В точке а существует одна жидкая фаза. Снижение в нтервале аb не вызывает образования паровой фазы. В точке b начинается испарение. Линия NbCХ является линией кипения или испарения. Количество паровой фазы по мере снижения давления будет увеличиваться. В данном случае процесс проходит обычным путем, т. е. это прямой процесс испарения при снижении давления над смесью.
2. Изменение состояния смеси по линии efdh при температуре t2, линия efdh расположена между критическими температурами, т. е. tкр.см<t2<tкон.см В точке е существует только газовая фаза, сохраняющаяся и при понижении давления в интервале еf. В точке f появляется жидкость (кривая CХfCRhO - кривая конденсации или точек росы). При дальнейшем снижении давления ниже точки f количество жидкости будет увеличиваться, но только до известного предела (до точки d), а затем уменьшаться, и в точке h будет опять только газовая фаза. В данном случае в интервале fd наблюдается явление обратной конденсации - образование конденсата при снижении давления. В интервале dh протекает прямой процесс - испарение жидкости при снижении давления. Если процесс вести снизу, то в этом интервале будет также прямой процесс - образование конденсата при повышении давления, а в интервале df - обратный процесс, т. е. испарение жидкости при повышении давления. Таким образом, процесс обратной конденсации или испарения может протекать только в зоне между критической температурой данной смеси и критической температурой ее конденсации, т. е. в температурном интервале от линия efdh расположена между критическими температурами, т. е. от tкр.см до tкон.см (между точками СХ и СR).
Рассмотрим изотермы конденсации для трех температур (рисунок 10.).
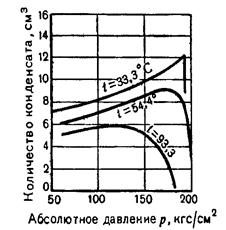
Рисунок 10. Изотермы конденсации
Из рисунка 10 видно, что каждой изотерме соответствует определенное давление, при котором образуется наибольшее количество конденсата. Это давление называют давлением максимальной конденсации. Также видим, что при более низкой температуре получается значительно больше конденсата. Для получения большего количества конденсата при эксплуатации газоконденсатного месторождения газ охлаждают.
|
|
|
Растворимость газов в жидкостях определяется по закону Генри устанавливающего зависимость между молярной концентрацией растворенного вещества и парциальным давлением пара под растворителем при постоянной температуре
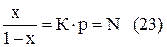
где N – весовая концентрация газа растворенного в жидкости;
р – давление;
К – коэффициент растворимости зависящей от температуры;
х – количество растворенного газа.
Для многокомпонентных газов растворимость каждого отдельного компонента пропорциональна его парциальному давлению
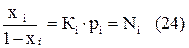
где хi – количество компонента растворенного в жидкости;
Ni, Ki, pi – соответственно концентрация в растворе, коэффициент растворимости и парциальное давление в газовой фазе компонента.
Закон Генри не распространяется на газы и жидкости химически взаимодействующие. С ростом давления наблюдается отклонение от закона Генри т.к. в этом случае коэффициент растворимости уменьшается в значительной степени.
ЛЕКЦИЯ № 6
 2014-02-05
2014-02-05 1266
1266








