Энтальпия химических реакций зависит только от вида и состояния исходных веществ и продуктов и не зависит от пути процесса при следующих условиях
1) Р или V = const
2) Единственным видом работы является объемная
3) Температура исходных веществ равна температуре продуктов
1ое следствие из закона Гесса
Тепловой эффект химической реакции равен разности сумм энтальпий образования продуктов реакции и сумм энтальпий образования исходных веществ с учетом стехиометрии
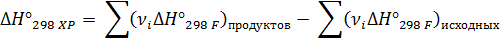
2ое следствие из закона Гесса
Тепловой эффект химической реакции равен разности сумм энтальпий сгорания исходных веществ и энтальпий сгорания продуктов, с учетом стехиометрии
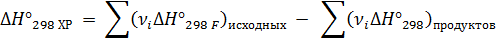
Стандартная энтальпия сгорания – это энтальпия реакции полного сгорания в кислороде 1моль вещества до высших оксидов при стандартных условиях
3е следствие из закона Гесса
Энтальпия реакции разложения химического соединения равна и противоположна по знаку энтальпии реакции образования этого соединения
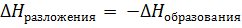
Значение закона Гесса
1) Позволяет определить энтальпии химических реакций без проведения эксперимента
2) Позволяет рассчитать энтальпии тех реакций для которых эксперемент невозможен
Зависимость энтальпий химических реакций от температур
 2014-02-05
2014-02-05 381
381








