КАРБАНИОНЫ
Пример расчета матрицы инерционных коэффициентов.
Запись уравнений движения ИМ с использованием матриц преобразования между СК звеньев.
Выражения движения получены с использованием компонент, определенных в СК0 (Ik(0), сj(0), Dkj(0), и т.д.). На практике чаще бывает удобно записать уравнения движения ИМ с ипользованием компонент, заданных в СК звеньев (Ik, сj (k), Dkj, и т.д.). Для этого преобразуем выразим сj(0), Dkj(0) в системы координат, связанные со звеньями так сj (k) = tk0 сj (0), Dkj(k) = tk0 Dkj(0) . Тогда, принимая во внимание, что
сj(0) = t0k сj (k), Dkj(0) = t0k Dkj (k),
получим
n n n
S aij q``j + bi = mдi + S сi(j) T Mвj + S Dji(j)T Fвj ,
j=1 j=i j=i
n
aij = S (сi(k) T tk0 Ik(0) t0k сj(k) + Dki(k)T tk0 mk t0kD(k)kj);
k=max(i,j)
n
aij = S (сi(k) T Ik сj(k) + Dki(k)T mk D(k)kj).
k=max(i,j)
n j
bi = S сi(j) T (Ij S l(wk) сk qk` + l(wj) Ij wj ) +
j=i k=1
n
S DjiT mj l(wj) l(wj)tj +
j = i
n j j
S DjiT mj tjk (S l(wk) l(wk)(vk (1-sk)qk + lk) + 2 S l(wk) (vk (1-sk)q`k) +
j = i k=1 k=1
j j l
l (S l(wk) vkskqk`) tj + S l (S l(wk) vkskqk`) tkl (vl (1-sl) q l + l l)).
k=1 l =1 k =1
Используется обозначение
tk0 Ik(0) t0k = Ik – тензор инерции звена k, заданный в СКk, совмещенной с центром масс этого же звена.
Металлоорганическими соединениями называют соединения со связью между атомом углерода и металлом.
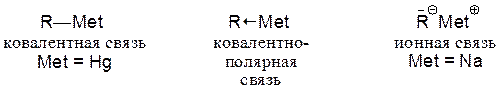
Степень ионности связи зависит от природы металла, т. е. от его электроотрицательности, от строения остатка R и природы растворителя. Во многих случаях вопрос, считать ли углеродную часть анионом, является умозрительным.
Так как карбанион (КА) имеет неподеленную электронную пару, то он является основанием, сопряженным с соответствующей кислотой, которая, в свою очередь, является сопряженной кислотой для этого карбаниона:

Чем слабее сопряженная кислота, тем больше сила основания, тем меньше устойчивость карбаниона, если под устойчивостью понимать устойчивость по отношению к донору протонов: чем меньше устойчивость карбаниона, тем легче он принимает протон от любого доступного источника и прекращает свое существование как таковой.
Сопряженные кислоты простых незамещенных КА (этил-, изопропил-анион) – чрезвычайно слабые, т. е. такие КА не то что очень неустойчивы в растворах, но вообще не существуют в них в относительно свободном состоянии.
Ряд относительной силы СН-кислот (в порядке уменьшения кислотности) и соответствующих им сопряженных оснований (в порядке увеличения основности карбанионов)
| кислота | основание | рКа |
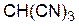
| 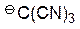
| -5 |
| HC(O)CH2C(O)H | 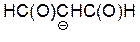
| |
| CH3C(O)CH2C(O)CH3 | 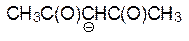
| |
| RCH2NO2 | 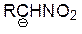
| |
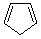
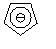
| 
| |
| RC(O)CH2R | 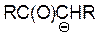
| 19 ÷ 20 |
| ROC(O)CH2R | 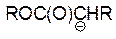
| 24,5 |
| HC≡CH | 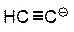
| |
| Ar3CH | 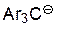
| 31,5 |
| PhCH3 | 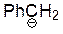
| |
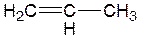
| 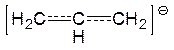
| |
| PhH | 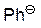
| |
| CH2=CH2 | 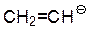
| |
| CH4 | 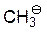
| |
| C2H6 | 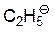
| |
| (CH3)2CH2 | 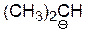
|
В ряду простых карбанионов устойчивость уменьшается следующим образом:
метил > первичные КА > вторичные КА > третичные КА.
Ряд относительной стабильности простых КА можно объяснить с помощью эффекта поля (индуктивного эффекта): повышение плотности отрицательного заряда на карбанионном центре влечет за собой уменьшение устойчивости КА:
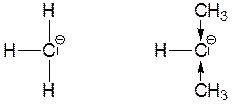
 2014-02-02
2014-02-02 467
467








