В разделе квантовой механики, рассматривающем свойства систем, состоящих из большого числа частиц таких как: сложный атом, электронный газ в металле, жидкий гелий, обнаруживший при низких температурах свойство сверхтекучести, прежде всего, следует учитывать принцип неразличимости одинаковых частиц.
Если частицы, описываемые классической механикой, тождественны между собой, то это вовсе не означает их неразличимости.
В квантовой механике понятие траектории отсутствует. Это приводит к весьма глубоким изменениям при описании свойств системы многих микрочастиц.
Одинаковые микрочастицы принципиально неразличимы. Это утверждение и составляет содержание квантово-механического принципа неразличимости одинаковых частиц. Этот принцип проявляется в неизменности физических свойств системы при перестановке пары частиц. Волновая функция в этом случае может принять два значения:
Y(r1, r2) = Y(r2, r1) или Y(r1, r2) = -Y(r2, r1).
Функция системы, состоящей из двух частиц, приих перестановке или остается неизменной, или меняет знак на противоположный. Волновые функции, удовлетворяющие первому условию, называются симметричными, а удовлетворяющие второму условию – антисимметричными.
|
|
|
Частицы, свойства которых описываются симметричными функциями (к ним относятся мезоны, фотоны, атомные ядра, состоящие из четного числа нуклонов, и др.) называются частицами, подчиняющимися статистике Бозе – Эйнштейна, или бозонами. Антисимметричными функциями описываются частицы, подчиняющиеся статистике Ферма – Дирака (к ним относятся электроны, позитроны, протоны, нейтроны, нейтрино и др.).
Для фермионов функция n, имеет вид: n = 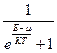 ,
,
а для бозонов n = 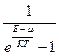 .
.
В этих выражениях m– химический потенциал системы, который представляет собой величину, численно равную изменению энергии в системе при добавлении к ней одной частицы. Если число частиц переменно, то m = 0. Так, для фотонов, энергия которых равна E = ћw, получаем известное выражение Планка:
n = 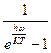 .
.
Заполнение энергетических уровней (оболочек) и электронных орбиталей (подуровней) происходит согласно трем законам.
Первый закон – принцип Паули (1924 г., швейцарский физик).
В атоме не могут одновременно существовать электроны, характеризующиеся одинаковым значениемвсех четырех квантовых чисел.
Второй закон – правило Хунда. На одной электронной орбитали могут находиться два электрона с противоположными спинами. Общий спин атома, равный сумме спиновых квантовых чисел всех его электронов, стремится быть максимальным.
Третий закон – принцип минимума энергии. Электроны в атоме стремятся занять положение с минимальным значением энергии, т.е. как можно ближе к ядру атома.
|
|
|
Принимая во внимание принцип Паули и учитывая 2 значения магнитного спинового квантового числа (ms = ±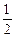 ), принцип Паули можно сформулировать и следующим образом: в атоме не может быть больше 2-х электронов, движение которых характеризуется одинаковым значением 3-х квантовых чисел n, l, me.
), принцип Паули можно сформулировать и следующим образом: в атоме не может быть больше 2-х электронов, движение которых характеризуется одинаковым значением 3-х квантовых чисел n, l, me.
Поскольку магнитное квантовое число me принимает 2 l +1 значений, то в сложных многоэлектронных атомах число электронов, характеризующихся одинаковыми, значениями 2-х квантовых чисел n и l,не превышает 2 (2 l + 1).
Максимальное число электронов на энергетическом уровне, характеризуемое значением одного квантового числа n, может быть подсчитано из условия, что l = n - 1 или 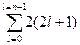 .
.
Эта сумма представляет сумму членов арифметической прогрессии, которая может быть вычислена по формуле: Sn = 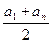 n, тогда
n, тогда 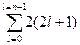 = 2
= 2 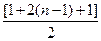 n = 2n2, или представим таблицей:
n = 2n2, или представим таблицей:
| Квантовые числа | Число электронов |
| n, l, me, ms | |
| n, l, me | |
| n, l | 2(2 l + 1) |
| n | 2n2 |
 2014-02-02
2014-02-02 372
372








