Из выражения для константы растворимости следует, что в насыщенном растворе труднорастворимого электролита произведение молярных концентраций его ионов есть величина постоянная при данной температуре.
Если в результате диссоциации формульной единицы такого электролита образуется несколько одинаковых ионов, например:
Ca3(PO4)2  3Ca2+ + 2PO43–,
3Ca2+ + 2PO43–,
то при вычислении KS равновесная молярная концентрация каждого из ионов возводится в степень, равную стехиометрическому коэффициенту, стоящему в уравнении диссоциации перед данным ионом
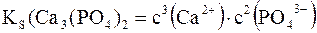
Такое произведение молярных концентраций ионов в дальнейшем будем называть стехиометрическим произведением.
Таким образом для любого труднорастворимого электролита 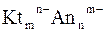 справедливо равенство
справедливо равенство

Константы растворимости, как и все константы равновесия, зависят от температуры, поэтому в справочной литературе они чаще всего приводятся для стандартных условий (T=298K и р=101,325 кПа) (табл. 14).
Таблица 14. Константы растворимости некоторых малорастворимых веществ при Т = 298 K
|
|
|
| Вещество | KS | Вещество | KS |
| 1. AgBr | 5,3 × 10–13 | 10. Ag2CO3 | 1,2 × 10–12 |
| 2. AgCl | 1,56 × 10–10 | 11. Ag2C2O4 | 3,5 × 10–11 |
| 3. AgI | 8,3 × 10–17 | 12. Ag2S | 6,3 × 10–50 |
| 4. Ca3(PO4)2 | 2,0 × 10–29 | 13. Ag2SO3 | 1,5 × 10–14 |
| 5. BaSO4 | 1,1 × 10–10 | 14. Ag2SO4 | 1,6 × 10–5 |
| 6. CaCO3 | 3,8 × 10–9 | 15. Ag3PO4 | 1,3 × 10–20 |
| 7. BaCO3 | 4,0 × 10–10 | 16. Mg(OH)2 | 5 × 10–12 |
| 8. SrCO3 | 1,1 × 10–10 | 17. CuS | 8,5 × 10–45 |
| 9. MgCO3 | 2,1 × 10–5 | 18. HgS | 4 × 10–53 |
На основании вышеизложенного материала формулируется так называемое правило растворимости осадков.
1. Если стехиометрическое произведение молярных концентраций ионов труднорастворимого электролита 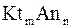 в растворе равно величине его KS (или ПР) при данной температуре
в растворе равно величине его KS (или ПР) при данной температуре

2. Если стехиометрическое произведение молярных концентраций ионов в растворе электролита меньше величины его KS
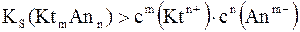
такой раствор является ненасыщенным и в нем будет наблюдаться преимущественный переход ионов электролита из твердой фазы в жидкую (т.е. растворение осадка).
3. В перенасыщенном растворе стехиометрическое произведение молярных концентраций труднорастворимого электролита больше величины его KS
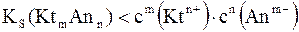
вследствие чего наблюдается переход ионов из жидкой фазы в твердую (т.е. выпадение осадка).
По величине KS труднорастворимого электролита можно рассчитать его растворимость, или коэффициент растворимости s и, наоборот, зная s, определить значение константы растворимости.
Пример 1. KS(BaSO4) = 1 × 10–11. Рассчитать коэффициент растворимости s этой соли в воде (г/дм3).
Решение. В насыщенном растворе сульфата бария устанавливается следующее равновесие:
BaSO4  Ba2+ + SO42–
Ba2+ + SO42–
При этом KS(BaSO4) = с(Ba2+) × c(SO42–)
Пусть с(Ba2+) = c(SO42–) = x моль/дм3
|
|
|
Подставим в уравнение для константы растворимости BaSO4 значения всех величин
1 × 10–10 = х2
и решим его относительно x

Так как n(Ba2+) = n(SO42–) = n(BaSO4), то в 1 дм3 насыщенного раствора BaSO4 при 25оС будет содержаться 1 × 10–5 моль BaSO4 (т.е. молярная растворимость BaSO4 составит 1 × 10–5 моль/дм3). Растворимость BaSO4, выраженная в г/дм3, будет равна:
s(BaSO4) = n(BaSO4) × M(BaSO4) = 1 × 10–5 × 233 = 2,33 × 10–3
Пример 2. Растворимость AgCl в H2O при 25оС равна 1,79 × 10–3 г/дм3. Рассчитайте KS(AgCl).
Решение. Зная массу соли, содержащуюся в 1 дм3 насыщенного раствора, можно рассчитать ее химическое количество
n(AgCl) = m(AgCl): M(AgCl) = 1,79 × 10–3: 143,5 г/моль»»1,25 × 10–5 моль
(т.е. молярная растворимость AgCl равна 1,25 × 10–5 моль/дм3)
Так как в растворе хлорида серебра n(Ag+) = n(Cl–) = n(AgCl), можно записать, что
KS(AgCl) = 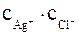 = 1,25 × 10–5 × 1,25 × 10–5 = 1,56 × 10–10
= 1,25 × 10–5 × 1,25 × 10–5 = 1,56 × 10–10
Для электролитов, формульные единицы которых содержат одинаковое число катионов и анионов, значения KS позволяют судить о их растворимости и сравнивать ее между собой. При этом чем меньше величина константы растворимости, тем, соответственно, меньше молярная растворимость данного вещества и тем более разбавленным будет его насыщенный раствор.
Так, например, на основе анализа данных табл. 14 карбонаты металлов IIА группы и соли серебра, образованные двухосновными кислотами, в порядке уменьшения растворимости можно расположить следующим образом:
| 1) | MgCO3 | > | CaCO3 | > | BaCO3 | > | SrCO3 |
| KS=2,1×10–5 | KS=3,8×10–9 | KS=4,0×10–10 | KS=1,1×10–10 |
| 2) | Ag2SO4 | > | Ag2CO3 | > | Ag2SO3 | > | Ag2S |
| KS=1,6×10–5 | KS=1,2×10–12 | KS=1,5×10–14 | KS=6,3×10–50 |
Для разнотипных электролитов, образующих при диссоциации разное число катионов и анионов, например: AgCl, Ag2SO4, Ag3PO4, сравнивать их растворимость по величине константы растворимости нельзя. В этом случае, зная KS, необходимо рассчитать молярную растворимость вещества, т.е. его равновесную концентрацию в насыщенном растворе, по формуле:
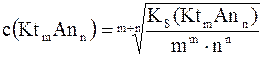
где m – число катионов (Ktn+), содержащееся в формульной единице электролита; n – число анионов (Anm – ), содержащееся в формульной единице электролита.
Например, для AgCl и Ag3PO4 их константы растворимости равны, соответственно, 1,5 × 10–10 и 1,3 × 10–20 (табл. 14), а равновесные молярные концентрации этих же солей в насыщенном растворе, рассчитанные по вышеприведенной формуле, имеют значения:
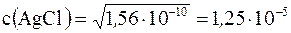 (моль/дм3)
(моль/дм3)
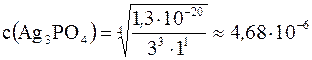 (моль/дм3)
(моль/дм3)
Таким образом (с учетом того, что формульная единица Ag3PO4 содержит в 3 раза больше ионов Ag+ по сравнению с AgCl), в насыщенном растворе Ag3PO4 равновесная концентрация ионов Ag+ (4,68 × 10–6 ´ 3 = 1,404 × 10–5 моль/дм3) выше, чем в аналогичном растворе AgCl.
 2014-02-02
2014-02-02 1195
1195








