Присоединение синильной кислоты
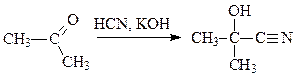
Лимитирующей стадией реакции является атака цианид-ионами карбонильного соединения. Синильная кислота является очень слабым электролитом, щелочь необходима для образования хорошей нуклеофильной частицы – цианид-иона CN-. Цианид-ион присоединяется к кетону с образованием алкоксид-аниона:
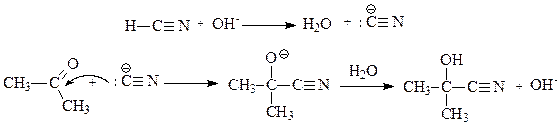
Процесс завершается взаимодействием алкоксид-аниона с молекулой HCN при проведении реакции в жидкой HCN, или завершается взаимодействием алкоксид-аниона с молекулой воды, если реакция проводится в водном растворе. Получаемые a-оксинитрилы можно использовать для получения a-гидроксикислот.
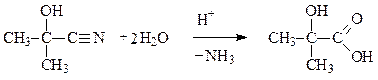
Реакции присоединения гидрид-ионов (реакции восстановления)
Взаимодействие карбонильных соединений с гидридами металлов (КН, NaH, СаН2 и др.) и комплексными гидридами (NaBH4, LiAlH4 и др.) протекает в два этапа. На первом идет нуклеофильное присоединение гидрид-иона, приводящее к образованию алкоголята, на втором – гидролиз алкоголята с образованием спирта и гидроксида металла.
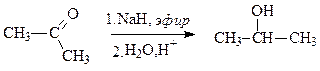
Из альдегидов образуются первичные спирты, из кетонов – вторичные.
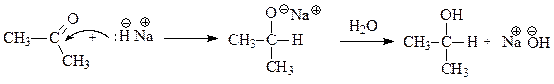
Реакции альдольной конденсации
Альдегиды и кетоны, имеющие в a-положении водородные атомы (С-Н кислотный центр), реагируя с основаниями, образуют стабилизированные карбанионы, способные атаковать атом углерода оксогруппы другой молекулы, что, в конечном счете, приводит к образованию альдоля. Уравнение реакции имеет следующий вид:
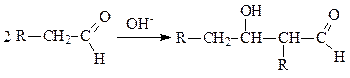
Механизм конденсации:
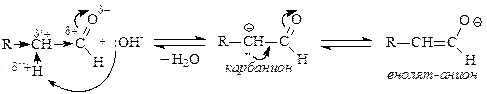
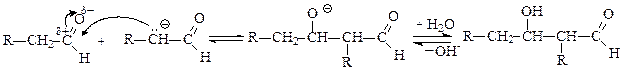
Альдегиды, не имеющие С-Н кислотного центра в a-положении, в реакцию альдольной конденсации не вступают. В этих условиях (щелочной катализ) они подвергаются диспропорционированию – реакция Канниццаро - Тищенко:
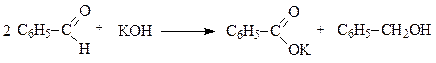
Гидроксид-ион при взаимодействии с субстратами, не имеющими кислотного центра, выступает не как основание, а как нуклеофил, который присоединяется к атому углерода карбонильной группы, в результате чего образуется алкоксид-анион. В анионе атом кислорода, несущий отрицательный заряд, выступает как сильный электронодонорный заместитель, смещающий от себя электронную плотность s -связи С¬О-, что приводит к увеличению электронной плотности и на атоме водорода, на нем в итоге возникает частичный отрицательный заряд. Этот атом водорода выступает в дальнейшем как нуклеофил – атакует атом углерода карбонильной группы другой молекулы альдегида. В возникающем переходном состоянии одновременно разрываются и образуются 2 s -связи и 2p-связи: в анионе образуется p-связь углерод-кислород и разрывается s -связь углерод-водород, в альдегиде – разрывается p-связь углерод-кислород и образуется s -связь водород-углерод. Анион превращается в карбоновую кислоту (оксиляется), а альдегид – в алкоголят-анион (восстанавливается). На последнем этапе идет кислотно-основное взаимодействие, результатом которого является образование спирта и карбоксилат-аниона (соли карбоновой кислоты):
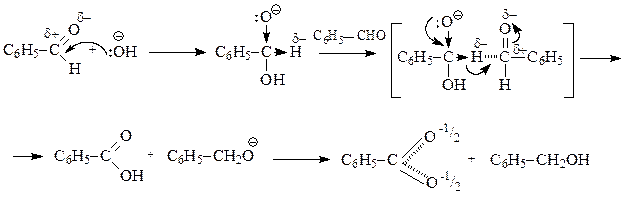
 2014-02-02
2014-02-02 3087
3087








