Лекция № 4
· Равновесные реакции, константа равновесия, кинетический и термодинамический контроль. Механизм реакции и пути его установления. Принцип микроскопической обратимости, постулат Хэммонда.
· Кислоты и основания в органической химии (теории Бренстеда-Лоури и Льюиса). Сопряженные кислоты и основания. Кислотно-основные равновесия. Константа кислотности (рКа), константа основности (рКb). Влияние заместителей на кислотность и основность органических соединений.
Особенность многих органических реакций состоит в том, что они равновесные.
aA + bB = dD + fF
Скорость прямой реакции: Vпр = KпрCAaCBb
Скорость обратной реакции: Vоб = KобCDdCFf
Когда скорости прямой и обратной реакции равны, наступает равновесие:
Vпр = Vоб
KпрCAaCBb = KобCDdCFf
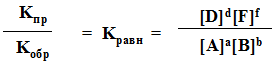
Кроме того, константу равновесия можно выразить через свободную энергию:
DG = - RT lnKравн
Важно: при наступлении состояния равновесия реакции не прекращаются. Одновременно протекают прямая и обратная реакция, но из-за постоянства концентраций исходных веществ и продуктов, кажется, что все процессы остановились. Просто скорости прямой и обратной реакции равны!
|
|
|
Если Vпр > Vобр, то в равновесном состоянии концентрации продуктов будут выше концентраций исходных веществ. Равновесие сдвинуто вправо. При Vпр < Vобр равновесие смещено влево, в сторону исходных веществ. Если в первом случае не удается выделить исходные соединения, считают, что реакция полностью прошла. Во втором случае, если не удается обнаружить продукты, реакция не идет.
 2014-02-02
2014-02-02 996
996








