Кислород образует двухатомную молекулу. С точки зрения метода МО ЛКАО молекула кислорода парамагнетик. Порядок связи равен 2, то есть связь между атомами кислорода двойная. По этой причине молекула кислорода устойчива. Энергия связи 498 кДж/моль (в то время как энергия одинарной связи О-О равна 210 кДж/моль), длина связи 121 пм (длина одинарной связи О-О 148 пм). Диссоциируют молекулы кислорода выше 1500 ºС.
Кислород – бесцветный газ без запаха и цвета. Конденсируется в жидкость светло-голубого цвета и твердое вещество синего цвета. Жидкий и твердый водород притягиваются магнитном, так как их молекулы парамагнитны.
Кислород мало растворим в воде: в 100 объемах воды при 0 ºС растворяется 4,89 объемов кислорода, а при 20 ºС – 3,10 объема. Хорошо растворим в неполярных растворителях.
Молекула кислорода неполярны. Молекулы кислорода слабо поляризуются (но поляризуемость выше, чем у азота), поэтому межмолекулярные связи между ними слабые. Вследствие плохой деформируемости электронной оболочки кислород имеет низкие температуры кипения и плавления: 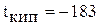 °С,
°С, 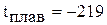 °С.
°С.
|
|
|
Известны три аллотропные модификации кислорода: О2, озон О3, и крайне неустойчивый тетракислород О4 (молекулы кислорода слабо ассоциируют в диамагнитные частицы О4, в которых все электроны спарены. Но такая ассоциация незначительна. Молекулы О4 были зафиксированы при газофазном взаимодействии катионов О4+, полученных из О2 и О2+ с парами цезия: 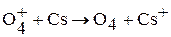 ).
).
 2014-02-03
2014-02-03 1435
1435








