Силы взаимодействия между молекулами, или, как их еще называют, Ван-дер-Ваальсовские силы имеют электрическую природу. Это кулоновские силы взаимодействия заряженных частиц, из которых состоят атомы и молекулы. Они проявляются на расстояниях, соизмеримых с размерами самих молекул и очень быстро убывают при увеличении расстояния. При этом одновременно действуют силы притяжения (взаимодействие разноименных зарядов) и силы отталкивания (взаимодействие одноименных зарядов). Т.к. реальные частицы не являются точечными, то величина этих сил зависит от расстояния между ними по-разному.
Различают три типа сил Ван-дер-Ваальса:
a) ориентационные – действуют между полярными молекулами:
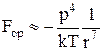 ,
,
где р – электрический дипольный момент частиц, r – расстояние между ними, k – постоянная Больцмана, Т – термодинамическая температура.
б) индукционные – описывают взаимодействие молекул, поляризация
зарядов в которых возникает под воздействием электрических полей соседних частиц:
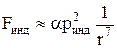 .
.
Здесь: ринд = ε0αЕ – приобретённый электрический дипольный момент частиц; α – поляризуемость молекул.
|
|
|
в) дисперсионные – определяют взаимодействие молекул, несимметричное распределение зарядов в которых возникает случайно, в процессе движения электронов по орбитам, что и приводит к образованию мгновенных диполей:
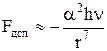 .
.
В общем случае все три типа сил могут действовать одновременно:
Fм = Fо + Fи + Fд.
Рассмотрим зависимость сил межмолекулярного взаимодействия от расстояния. Силы притяжения Fпр считаются отрицательными, а силы отталкивания Fот – положительными. Сумма этих сил дает результирующую – Fрез = f(r). На некотором расстоянии r0 между молекулами |Fпр| = |Fот| и результирующая сила F = Fпр + Fот = 0. Если r < r0, то преобладают силы отталкивания. Если r >r0, то преобладают силы притяжения. Однако на расстоянии r > 10-9 м силы Ван-дер-Ваальса быстро стремятся к нулю.
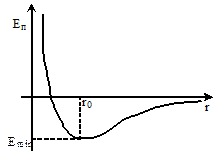 Система взаимодействующих молекул характеризуется некоторым запасом потенциальной энергии, которая сложным образом зависит от r, Еп = f(r):
Система взаимодействующих молекул характеризуется некоторым запасом потенциальной энергии, которая сложным образом зависит от r, Еп = f(r):
r → ∞ – Еп → 0;
r > r0 и r → r0 – Еп → Еп min, Еп < 0;
r = r0 – Еп = Еп min , Еп < 0;
r < r0 и уменьшается – Еп → ∞, Еп > 0.
Наименьшая потенциальная энергия взаимодействия называется энергией связи молекул. Она равна работе, которую необходимо совершить против сил притяжения, чтобы разъединить молекулы, находящиеся в равновесии.
Соотношение минимальной потенциальной энергии (Еп min) и величины удвоенной средней энергии теплового движения приходящейся на одну степень свободы 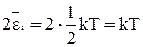 является критерием агрегатного состояния вещества. Если:
является критерием агрегатного состояния вещества. Если:
а) Еп min << kT – газ;
|
|
|
б) Еп min» kT – жидкость;
в) Еп min >> kT – твердое тело.
Таким образом, любое вещество в зависимости от температуры может находиться в газообразном, жидком или твердом агрегатном состоянии.
 2014-02-18
2014-02-18 498
498








