Продолжение Приложения Е
Продолжение Приложения Е
Приложение Е
Приложение Д
Приложение Г
Приложение Б
Приложение А
Список рекомендуемой литературы
1 Габриэлян, О.С.Химия для профессий и специальностей технического профиля: Учебник [Текст] – М. Академия, 2013. – 256 с.
2 Габриэлян, О.С.Химия для профессий и специальностей социально-экономического и гуманитарного профилей: Учебник [Текст] – М. Академия, 2013. – 208 с.
3 Ерохин, Ю.М. Химия: Учебник для студентов учреждений среднего профессионального образования [Текст] – М.: Академия, 2013. – 400 с.
4 Рябов, М.А. Тесты по химии к учебнику О.С. Габриэляна «Химия. 10 класс. Базовый уровень» [Текст]/ М.А. Рябов. – 2-е изд., перераб. и доп. – М.: Издательство «Экзамен», 2012. – 125 с.
Названия кислот и кислотных остатков
| кислотный гидроксид | кислотный остаток | кислотный гидроксид | кислотный остаток |
| HAsO2 - метамышьяковистая | AsO2- - метаарсенит | H2Cr2О7 - дихромовая | Cr2O72- -дихромат |
| H3AsO3 - ортомышьяковистая | AsO33- - ортоарсенит | - | FeO42- -феррат |
| H3AsO4 - мышьяковая | AsO43- - арсенат | HIO3 - иодноватая | IO3- -иодат |
| - | В4О72- - тетраборат | HIO4 - метаиодная | IO4- -метапериодат |
| - | ВiО3- - висмутат | H5IO6 - ортоиодная | IO65- -ортопериодат |
| HBrO - бромноватистая | BrO- - гипобромит | HMnO4 - марганцовая | MnO4- -перманганат |
| HBrO3 - бромноватая | BrO3- - бромат | - | MnO42- -манганат |
| H2CO3 - угольная | CO32- - карбонат | - | MоO42- -молибдат |
| HClO - хлорноватистая | ClO- -гипохлорит | H2CrO4 - хромовая | CrO42- -хромат |
| HClO2 - хлористая | ClO2- -хлорит | - | НCrO4- -гидрохромат |
| HClO3 - хлорноватая | ClO3- -хлорат | - | ReO4- -перренат |
| HClO4 - хлорная | ClO4- -перхлорат | H2SiO3 - метакремниевая | SiO32- - метасиликат |
| HNO2 - азотистая | NO2- -нитрит | H4SiO4 - ортокремниевая | SiO44- -ортосиликат |
| HNO3 - азотная | NO3- -нитрат | H2TeO3 - теллуристая | TeO32- -теллурит |
| HPO3 - метафосфорная | PO3- -метафосфат | H2TeO4 - метателлуровая | TeO42- -метателлурат |
| H3PO4 - ортофосфорная | PO43- -ортофосфат | H6TeO6 - ортотеллуровая | TeO66- -ортотеллурат |
| НPO42- -гидроортофосфат | - | VO3- -метаванадат | |
| Н2PO4- -дигидроотофосфат | - | VO43- -ортованадат | |
| H4P2O7 - дифосфорная | P2O74- -дифосфат | - | WO43- -вольфрамат |
| - | SO32- -сульфит | H2SeO3 - селенистая | SeO32- -селенит |
| HSO3- -гидросульфит | H2SeO4 - селеновая | SeO42- -селенат | |
| H2SO4 - серная | SO42- -сульфат | H2S2O7 - дисерная | S2O72- -дисульфат |
| - | НSO4- -гидросульфат | H2S2O6(O2) - пероксодисерная | S2O6(O2)2- -пероксодисульфат |
| H2SO3S - тиосерная | SO3S2- -тиосульфат |
Стандартные окислительно-восстановительные потенциалы
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Приложение В
Электронные конфигурации и степени окисления 4 f -элементов (лантаноидов)
|
Электронные конфигурации и степени окисления 5f-элементов (актиноидов)
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Основные функциональные группы органических соединений
| Функциональные группы | Класс соединения | |
| обозначение | название | |
| - F, - Cl, - Br, - I | галоген | Галогенопроизводные углеводородов |
| - OH | гидроксил | спирты, фенолы |
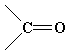
| карбонил | альдегиды, кетоны |
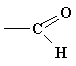
| карбоксил | карбоновые кислоты |
| - NH2 | аминогруппа | амины |
| - NO2 | нитрогруппа | нитросоединения |
Префиксы и суффиксы для обозначения некоторых характеристических групп
| Характеристическая группа | Префикс | Суффикс |
- (С)OOH*
- СООН
- SO3H
- (С)H= O
- СH= O
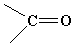 - OH
- SH
- NH2
- OH
- SH
- NH2
| - карбокси сульфо- оксо- формил- оксо- гидрокси- мерканто- амино- | -овая кислота -карбоновая кислота -сульфокислота -аль -карбальдегид -он -ол -тиол -амин |
| - NO2 - OR - F, - Cl, - Br, - I (-Hal) | нитро- алкокси- фтор-, хлор-, бром-, иод- (галоген-) | - - - |
* Атом углерода, заключенный в скобки, входит в состав главной углеродной цепи.
Краткая характеристика углеводородов
| Предельные углеводороды. | Непредельные углеводороды. | Ароматические или Арены | ||||
| Алканы | Циклоалканы | Алкены | Диеновые | Алкины | ||
| 1.Общая формула | CnH2n CH4-МЕТАН С6Н12-ГКСАН С10Н22-ДЕКАН | CnH2n С6Н12-ЦИКЛОГЕКСАН С3Н6-ЦИКЛОПРОПАН С4Н8-ЦИКЛОБУТАН | CnH2n С2Н4-ЭТЕН С6Н12-ГЕКСЕН С4Н8-БУТЕН | CnH2N-2 С3Н8-ПЕНТАДИЕН С3Н4-ПРОПАДИЕН С6Н10-ГЕКСАДИЕН | CnH2N-2 С3Н4-ПРОПИН С4Н6-БУТИН С7Н12-ГЕПТИН | CnH2n-6 С6Н6-БЕНЗОЛ С7Н8-ТУЛУОЛ С8Н10-КСИЛОЛ |
| 2Строение | ||||||
| А) тип гибридизации | sp3 -гибридизация | sp3 -гибридизация | sp2-гибридизация | sp-гибридизация | sp-гибридизация | sp2-гибридизация |
| Б) угол связи | ∟ 109*28' | ∟ 60*, 90*, 100*, 120* | ∟120* | ∟ 120* | ∟ 180* | ∟ 120* |
| В) длина связи (нм) | 0,154 | 0,154 | 0,134 | 0,134 | 0,12 | 0,142 |
| Г) форма молекулы | тетраэдр | стремится к тетраэдру | плоская | плоская | линейная | плоская |
| Д) структурная формула | H H C H (МЕТАН) H | CH2 CH2---------CH2 (ЦИКЛОПРОПАН) | Н H C=C H H (ЭТЕН) | CH2=C=CH2 (ПРОПАДИЕН 1,2) | HC≡CH (ЭТИН) |     CH
CH (БЕНЗОЛ)
HC
HC CH
CH CH
CH (БЕНЗОЛ)
HC
HC CH
CH
|
| 3 Изомерия углеводородов | ||||||||||||
| 1 Структурная | По положению заместителя в ядре! | |||||||||||
| А) строение углеродного скелета | 1) H3C-CH2-CH2-CH3 (Бутан) 2)H3C-CH-CH3 CH3 (2метил пропан) | 1) CH2-CH-CH3 CH2-CH2 (метил бутан) | 1) CH2=CH-CH2-CH3 (бутен 1) 2) CH2=C-CH3 CH3 (метилпрорен 1) | 1)CH2=C=CH-CH2-CH3 (пентадиен 1,2) 2)CH2=C=C-CH3 CH3 (2метилБутадиен1,2) | 1)CH≡C-CH2-CH2-CH3 (пентин 1) 2)CH≡C-CH-CH3 CH3 (2метилбутин1) | 1)
 CH3 CH3
  CH3
-ортоксилол
2) CH3 CH3
-ортоксилол
2) CH3
CH3
CH3 параксилол | ||||||
| Б) по положению двойной (тройной) связи | CH2=CH-CH2-CH3 (бутен 1) CH3-CH=CH-CH3 (бутен2) | 1)CH2=C=CH-CH2-CH3 (пентадиен 1,2) 2)CH3=CH-CH=CH-CH3 (пентадиен 1,3) | 1)CH≡C-CH2-CH3 (бутин 1) 2)CH3-C≡C-CH3 (бутин 2) | |||||||||
| В) с углеводородом Другого класса | 1)с алкенами 2) CH CH2=CH-CH3 CH--------CH (пропен) (циклопропан) | С циклоалканами (см циклоалканы) | С алкинами (см Алкины) | С диеновыми: 1) CH2=C=CH2 (пропадиен) 2) CH≡C-CH3 (пропин) | ||||||||
| Г) по положению радикала | 1) CH2-CH-CH3 2)CH2-CH-CH3 CH2-CH-CH3 CH3-CH-CH2 (1,2диметилбутан) (1,3диметилбутан) | |||||||||||
| 2 Пространственная | ||||||||||||
| Д)Пространственная изомерия (цис-транс изомерия) | CH3 CH3 CH3 H C=C C=C H (цис) H H (транс) CH3 | CH3 CH=CH2 CH3 H C=C C=C H H H CH=CH2 |
| 3Химические свойства углеводородов | ||||||
| А)Горение | CH4+O2→CO2+H2O+Q МЕТАН | CH2 CH2-----CH2+O2→CO2+H2O+Q | С2H4+O2→CO2+H2O+Q ЭТЕН | Те же свойства что и у алкенов но реакции происходят в 2 этапа! | 1.полное сгорание 2C2H2+5O2→4CO2+2H2O+Q 2 неполное сгорание С2H2+O2→C+H2O | 1.полное сгорание C6H6 +O2→CO2+H2O 2. Неполное сгорание C6H6+O2→C+H2O+Q |
| Б)Термическое разложение | C4H10→4C+5H2+Q БУТАН | С2H4→C+H2-Q ЭТЕН | 1. CH2=CH-CH=CH2+H2→ бутадиен CH2-CH=CH-CH2 Бутен2 H H 2. CH3-CH=CH=CH3+H2→ бутэн2 CH3-(CH2)2-CH3 бутан | C2H2→C+H2 | C6H6→C+H2-Q | |
| В)р замещения | *CH4+CL2→CH3CL+HCL хлорметан *CH3CL+CL2→CH2CL2+HCL дихлорметан *CH2CL2+CL=CHCL3+HCL Трихлорметан *CHCL3+CL2→CCL4+HCL тэтрахлорметан | C7H14+Br2→C7H13Br+HBr (бромциклогептан) | 1. C6H6+CL2→C6H5-CL хлорбензол 2.C6H6+HNO3→C6H5-NO3 нитробензол | |||
| Г)Р присоединения (+H2, +H HAL,+HAL2, +H2O) | Р изомеризации CH3-CH2-CH2-CH3→ CH3-CH-CH3 CH3 (2 МЕТИЛПРОПАН) | CH CH2—CH2+H2→CH3-CH2-CH3 (пропан) СH2 CH2-CH2+Br2→CH2+CH2+CH2 (1,3ДИБРОМПРОПАН) Br Br | *CH2=CH2+H2→CH3+CH3 ЭТАН *С2H4+HOH→CH3-CH2OH ЭТАНОЛ *C2H4+HCL→CH3-CH2CL ХЛОРЭТА Н *C2H4+CL2→CH2CL-CH2CL ДИХЛОРЭТАН | 2 ЭТАПА: ≡→=→- 1. CH≡CH+2H2→CH3-CH3 ЭТИН 2. СH≡CH+2CL2→ ЭТИН CHCL2-CHCL2 (1122ТЕТРАХЛОЭТАН) 3. C2H2+2HCL→CH2CL=CH2CL 1,2 ДИХЛОРЭТАН 4. C2H2+H2O→CH3-C=O H (Альдегид) | 1. Гидрирование C6H6+3H2→C6H12 (циклогексан) 2.C6H6+3CL2→C6H5CL | |
| Д) Полимеризация | *2С2H4+O2→2CH2-CH2 | n(CH2=CH-CH=CH2) → ДИВИНИЛ (-CH2-CH=CH-CH2-)n поливинил | 3C2H2→C6H6 (Бензол) |
Основание для сравнения
| По предмету правового регулирования | Отношения, возникающие в оде отправления правосудия по гражданским делам | Имущественные, и тесно связанные с ними личные неимущественные отношения. |
| По положению субъектов | Все субъекты находятся в отн власти и подчинения. По вертикали. | Равны. отношения строятся по горизонтали. |
| По методу | Императивно-дисползитивный | Диспозитивный |
| По характеру действия правовых норм | Разрешено только то, что прямо предусмотрено в законе. | разрешено все, что не запрещено законом |
| По характеру прав субъектов | Права субъектов являются правами на одностороннее волеизъявление. Реализации стороной своего права не влечет за собой необходимости исполнения к-либо обязанности другим субъектом. Договор – редкое исключение, например – мировое соглашение, соглашение о подсудности. | Права субъектов корреспондируют друг другу, вытекают из договоров |
 2014-02-24
2014-02-24 702
702
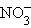 + H2O
+ H2O
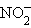 + 2OH–
+ 2OH–
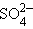 + 2H+
+ 2H+
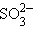 + 2H2O
+ 2H2O
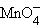
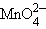
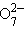 + 14H+
+ 14H+

 3) CH3
3) CH3






