Коррозионностойкие и жаростойкие стали и сплавы
Коррозия металлов - это разрушение, вызванное химическим или электрохимическим воздействием внешней среды.
К химической коррозии относятся все виды химического разрушения материалов, не связанные с переносом электрического заряда. К ним принадлежат и окисление металла при нагреве, и газовая коррозия в парах и газах сгорающего топлива (например, в двигателях внутреннего сгорания), коррозия в жидкостях, не проводящих электрического тока (в спиртах, различных органических жидкостях).
Электрохимическая коррозия осуществляется в присутствии электролитов и может быть атмосферной (во влажном воздухе), почвенной и в других средах, например морской воде, растворах кислот, щелочей, в расплавах солей.
По характеру разрушения коррозию подразделяют на равномерную или общую, при которой поверхность разрушается равномерно; локальную коррозию, протекающую в отдельных участках поверхности; точечную или питтинговую, для которой характерно появление изъязвлений материала в отдельных точках, а также межкристаллитную (по границам зерен). Локальная и межкристаллитная коррозия более опасны, чем общая равномерная коррозия, так как могут скорее привести к местному разрушению материала.
|
|
|
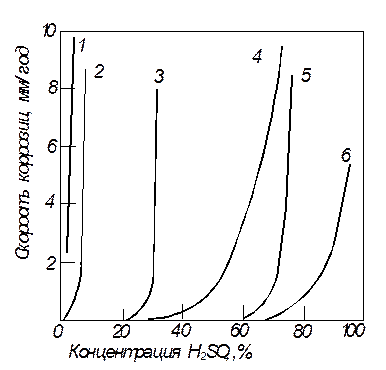
Рис. 8. Скорость коррозии различных металлов в кипящей серной кислоте:
1 - хромистая сталь; 2 - хромомолибденовая сталь; 3 - хастеллой; 4 – ниобий;
5 - молибден; 6 - тантал
Скорость коррозии зависит от конкретных условий службы изделия.Ее, как правило, выражают потерей массы единицей площади поверхности за единицу времени (кг/м2 . с). Если же образовавшаяся при коррозии пленка прочно держится на поверхности кристалла, то скорость коррозии определяют по увеличению массы. Поскольку пленка и образуется и растворяется, часто скорость общей коррозии оценивают глубиной разрушенной части изделия в миллиметрах в год (мм/год) (рис. 8).
Коррозионную стойкость материалов оценивают и по группам стойкости и по баллам (табл. 9).
При межкристаллитной коррозии ее скорость целесообразно определять не по изменению массы, а гораздо проще оценивать поражение материала либо по электропроводности, либо по изменениям механических свойств.
Таблица 9
Группы коррозионной стойкости сталей и сплавов
| Группа стойкости | Балл | Скорость коррозии, мм/год |
| Совершенно стойкие (СС) Весьма стойкие (ВС) | <0,001 >0,001-0,005 >0,005-0,01 | |
| Стойкие (С) | >0,01-0,05 >0,05-0,1 | |
| Пониженно-стойкие (ПС) | >0,1-0,5 >0,5-1,0 | |
| Малостойкие (МС) | >1,0-5,0 >5,0-10,0 | |
| Нестойкие (НС) | >10,0 |
В результате соприкосновения с воздухом даже при обычных температурах на поверхности металлов образуется тончайший слой оксидов, защищающих их от дальнейшего окисления. В зависимости от условий образования толщина защитной (пассивирующей) пленки может меняться от 30…40 нм до 0,5…1 мм.
|
|
|
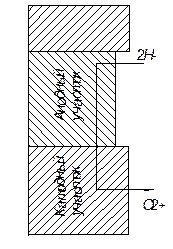
Рис. 9. Схема гальванического элемента
Пленки по своему строению пористы, и их проницаемость для различных реагентов неодинакова, причем если количество и размеры пор велики, то пленки продолжают расти практически с постоянной скоростью. Чем выше защитные свойства пленки, тем с меньшей скоростью она растет. В общем случае скорость роста обратно пропорциональна толщине пленки, так что ее толщина возрастает по параболическому закону. Скорость газовой коррозии можно изменить, регулируя состав внешней среды.
Большинство металлов разрушается в результате электрохимической коррозии.
Коррозия в электролитах не происходит путем непосредственного соединения металла с другими элементами, а осуществляется более сложными путями.
В соответствии с современной теорией коррозии металлов в электролитах считается, что процесс заключается в работе множества микроскопических коротко замкнутых гальванических элементов, образующихся на поверхности в результате его электрохимической неоднородности по отношению к окружающей среде (рис. 9). Участки металла с более электроотрицательными потенциалами становятся анодами и растворяются. Возникновение разности потенциалов на поверхности металла обусловлено различиями работы перехода заряда из различных структурных составляющих сплава в раствор электролита. На участке, где происходит растворение металла, освободившиеся электроны переходят от анода к катоду. На катоде происходит реакция восстановления ионов. Чаще всего это - ионы водорода. При их восстановлении происходит выделение газообразного водорода. Может происходить и ионизация кислорода с образованием иона гидроксила.
Большинство коррозионных процессов определяется скоростью и характером катодных процессов. При коррозии в нейтральной воде, а также почве скорость разрушения определяется скоростью поглощения и ионизации кислорода. Водородная коррозия встречается преимущественно в кислых растворах. В нейтральных и даже щелочных растворах водородная коррозия может происходить только для металлов с очень электроотрицательным потенциалом. В результате осуществления электродных процессов, в приэлектродных пространствах изменяются концентрации ионов. Поэтому скорость коррозии в электролитах может определяться и количеством металла, растворенного на единице его поверхности.
На скорость коррозии влияют как внутренние (природа коррозирующего металла и его структура), так и внешние факторы (температура, давление, состав среды). В случае образования на поверхности металла защитных труднорастворимых пленок коррозия замедляется. Укрупнение зерна может не влиять на общую коррозию, но усиливает межкристаллитную коррозию.
Важное значение имеет поляризация - явление, обусловленное выделением продуктов электролиза на электродах и приводящее к возникновению ЭДС, действующей в направлении, обратном ЭДС, создаваемой гальванической парой. Поляризация зависит от электрохимических свойств электродов. Если они сильно поляризуются, то коррозия протекает медленнее, несмотря на неоднородность структуры металла.
Внешняя среда часто оказывает большее влияние на скорость коррозии, чем свойства и структура материала. Одним из важнейших показателей внешней среды является ее рН. От величины этого показателя зависит способность материала к пассивации или к депассивации. Так, никель устойчив в нейтральных и щелочных растворах и корродирует в кислотах, железо быстрее корродирует в кислых и нейтральных средах, чем в щелочных. Соли часто, не меняя рН растворов, влияют на поляризацию электродов и тем самым на скорость коррозии.
|
|
|
В технике известно много случаев, когда коррозия идет в наиболее напряженных участках конструкции (коррозия под напряжением). Одновременное воздействие напряжений и коррозии приводит к коррозионному растрескиванию.
Для защиты металлов от коррозии, прежде всего, создают специальные составы коррозионностойких материалов, которые будут рассмотрены дальше. Но одним изменением составов сталей не всегда целесообразно подавлять их коррозию. Существуют специальные способы защиты, к которым относят применение защитных покрытий, электрохимическую защиту и химическую обработку среды, в которой происходит коррозия.
Наиболее распространенным способом является применение металлических и неметаллических покрытий, наносимых химическим или электрохимическим путем. Роль покрытий сводится к устранению контакта защищаемой поверхности от воздействия внешней среды, поэтому в зависимости от условий работы изделия требования к свойствам могут быть различными. Так, при эксплуатации изделий в жилых помещениях, когда они не соприкасаются с агрессивными средами, для защиты бывает достаточно использовать их окраску. В случае работы изделий в изменяющихся атмосферных условиях, в морской воде или в агрессивных средах (кислотах, щелочах и т. п.) поверхности изделий защищают металлическими и неметаллическими (органического происхождения) пленками. Для защиты изделий используют хромирование, алитирование, силицирование, борирование, цинкование, меднение, серебрение, титанирование и другие способы нанесения покрытий, которые были рассмотрены в гл. 6.
При электрохимических методах защиты (приложенным извне напряжением) уменьшения скорости коррозии достигают путем облегчения катодной поляризации защищаемого изделия. Электрохимический метод защиты хорошо применять в морской воде. В речной воде из-за большого электросопротивления его эффективность мала, при атмосферной коррозии его применение вообще нецелесообразно.
|
|
|
Защита металлов от коррозии путем обработки внешней среды заключается в добавлении к агрессивным средам специальных веществ (ингибиторов), замедляющих коррозию. Так, для защиты сталей от коррозии в водных средах в качестве ингибиторов применяют нитрит натрия (NaNO2), хроматы и бихроматы (K2CrO4, K2Cr2O7), снижающие содержание кислорода и облегчающие поляризацию. Получили также распространение летучие или парофазные ингибиторы, например углекислая соль этаноламина. Их вводят, например, в оберточную бумагу, в которой транспортируют металл.
 2014-02-09
2014-02-09 997
997








