Зависимость величины адсорбции от давления (для газов) или концентрации (для растворов) дается уравнением Ленгмюра. Обозначим:
 x – число центров адсорбции на единице поверхности;
x – число центров адсорбции на единице поверхности;

 y – число занятых центров адсорбции на той же поверхности;
y – число занятых центров адсорбции на той же поверхности;

Рис. 2. Свободные и занятые центры адсорбции на поверхности адсорбента.
Скорость адсорбции пропорциональна числу свободных центров
va = ka (x – y) p
Скорость десорбции пропорциональна числу занятых центров
vd = kdy
В состоянии равновесия
va = vd или
kdy = ka (x – y) p
Адсорбция равна отношению числа центров к числу Авогадро:
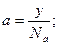
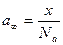
kdа = ka (а∞ – а) p
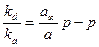 ;
; 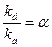 ; α – константа адсорбционного равновесия;
; α – константа адсорбционного равновесия;
После подстановки α и преобразования получаем
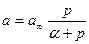 – уравнение Ленгмюра
– уравнение Ленгмюра
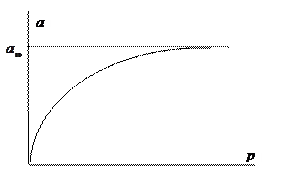
Рис. 3. Изотерма адсорбции
Для определения постоянных этого уравнения, то есть предельной адсорбции а ¥ и константы адсорбционного равновесия α переменные величины – адсорбцию и давление (концентрацию в случае адсорбции из растворов) – преобразуют в обратные им значения:
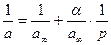
|
|
|
График в координатах 1/ р (1/ с) – 1/ а оказывается прямой линией, что облегчает определение постоянных адсорбции.
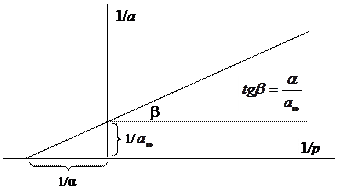
Рис 4. Графическое определение постоянных адсорбции
Нередко применяется также уравнение изотермы Фрейндлиха
a = k ∙ pn
где a – количество адсорбированного вещества, – константа, численно равная адсорбции при равновесном давлении газа 101,3 кПа (1 атм), моль/(кг∙кПа); р – давление газа, кПа; n – константа, определяющая кривизну изотермы адсорбции, ее значение колеблется в пределах от 0,1 – 0,6.
 2014-02-09
2014-02-09 7061
7061








