Реакции нулевого порядка
В случае реакции нулевого порядка m + n = 0
v = k0
 Скорость реакции не зависит от концентрации исходных веществ (а).
Скорость реакции не зависит от концентрации исходных веществ (а).
Единица измерения константы скорости и скорости одна и та же.
Концентрация исходного вещества линейно уменьшается до нуля;
это характерно для многих гетерогенных (идущих на поверхности раздела фаз) реакций в том случае, когда скорость диффузии реагентов к поверхности меньше скорости их химического превращения.
Реакции нулевого порядка встречаются редко.
В случае реакции первого порядка m + n = 1 и скорость реакции пропорциональна концентрации исходного вещества:
v = kI×cA
При реагировании вещества его концентрация снижается и поэтому уменьшается и скорость реакции.
Исходя из уравнения 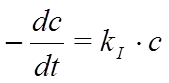
можно кинетическое уравнение реакции 1-го порядка путем интегрирования преобразить к виду:
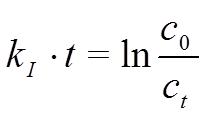
где c0 – начальная концентрация и
ct – концентрация в момент времени t
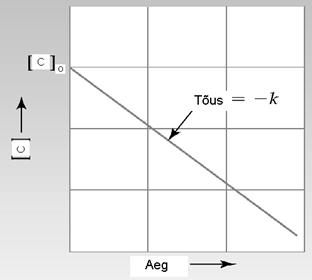
Зависимость логарифма концентрации от времени для реакций первого порядка
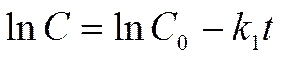
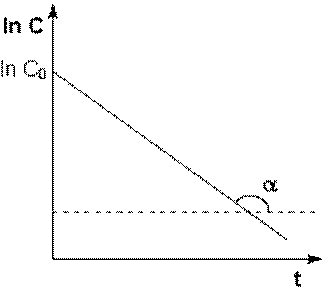
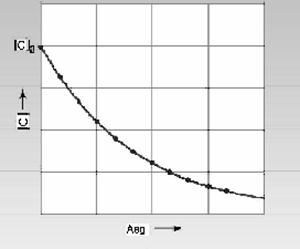
Концентрация исходного вещества в реакции 1-го порядка спадает экспоненциально:
ct = c0×e–kt
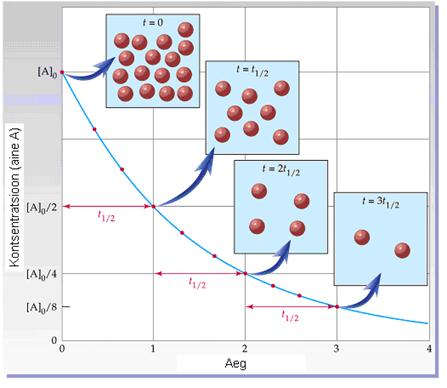
В случае реакции 1-го порядка концентрация исходного вещества спадает в 2 раза в течение определенного интервала времени – этот интервал называется периодом полупревращения (poolestusajaks) t.
Подставляя величину уменьшенной наполовину начальной концентрации ct = 0,5×c0, можем рассчитать время полупревращения:
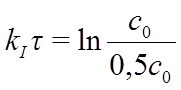
и
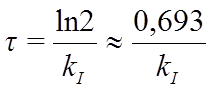
Для реакций 1-го порядка период полупревращения является постоянной величной и зависит только от константы скорости реакции.
 2014-02-09
2014-02-09 1992
1992








