Принято делить химические элементы на металлы и неметаллы с учётом физических и химических свойств простых веществ.
Металлы обычно твёрдые, пластичные вещества, обладают характерным блеском, хорошо проводят тепло и электричество.
Неметаллы объединяет то, что электричество они проводят гораздо хуже, чем металлы. Отличие проявляется и в свойствах сложных веществ.
Неметаллы весьма разнообразны по свойствам. Углерод в форме графита – хороший проводник тепла и электричества, но, в отличие от металлов, хрупкий и не куётся. Твёрдые вещества с металлическим блеском: C, Si, As, I.
Неметаллы дают кислотные оксиды (например, CO2) или несолеообразующие оксиды (например, NO), в растворах они присутствуют обычно в виде анионных форм (например, S2– и SO42–).
Металлам в низких степенях окисления отвечают основные оксиды, основания и катионные формы в растворах (например, Fe2+).
В Периодической таблице можно провести условную границу между металлами и неметаллами. Она проходит по p-элементам от бора к астату. Неметаллы располагаются правее и выше этой границы. Обычно к ним относят 22 элемента: 6 инертных газов (от He до Rn), водород H и 5 галогенов (от F до At), 4 халькогена (от O до Te), в V группе: N, P, As, в IV группе: C, Si, в III группе: B. Условно водород иногда относят к VII группе.
В таблице указаны также относительные электроотрицательности элементов (ОЭО), характеризующие полярность связи и активность неметалла:
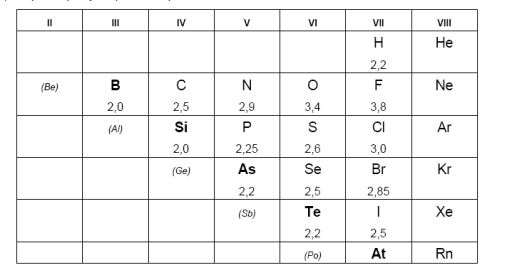
Все d-, f- и s-элементы (кроме водорода и гелия) – металлы.
 2014-02-10
2014-02-10 726
726







