При 25°С и 1 атм He, Ne, Ar Kr, Xe, Rn – газы, состоящие из одноатомных молекул.
Из двухатомных молекул состоят галогены в газе (F2, Cl2), жидком состоянии (Br2) и в кристаллах (I2). Так как молекулы лёгкие и слабо взаимодействуют друг с другом, бром и йод легко испаряются. При обычных условиях двухатомными газами являются также водород, кислород и азот: H2, O2, N2.
Остальные неметаллы – твёрдые. Они могут существовать в формах (модификациях), отличающихся своим строением. Напомню, это явление называют полиморфизмом. Так, углерод известен в виде графита, алмаза и других форм, фосфор – в белой, красной, чёрной и других формах.
Модификации, имеющие молекулярное строение – обычно легкоплавкие, летучие, хорошо растворяются в неполярных органических растворителях: белый фосфор P4, жёлтый мышьяк As4, ромбическая сера S8, красный селен Se8.
Более прочны немолекулярные модификации. В серых селене и теллуре система химических связей распространяется в одном пространственном измерении (D=1), в графите, чёрном фосфоре и сером мышьяке D=2, в алмазе, кремнии и боре D=3. Увеличение D способствует снижению химической активности.
|
|
|
Химическая связь в простых веществах неметаллов: ковалентная, так как их атомы обладает высокой электроотрицательностью. Электроны соседних атомов создают общую электронную пару, а в пространстве между ядрами создаётся область повышенной электронной плотности.
Различают сигма-связь (σ-связь), когда эта область лежит на линии, соединяющей ядра, и пи связь (π-связь), когда она находится в стороне.
π-связь обычно менее прочна, чем σ-связь и образуется, когда линия ядро-ядро уже занята σ-связью. Если в соединении есть двойная связь, то одна из них σ-, другая π-. В случае тройной связи есть одна σ- и две π-связи.
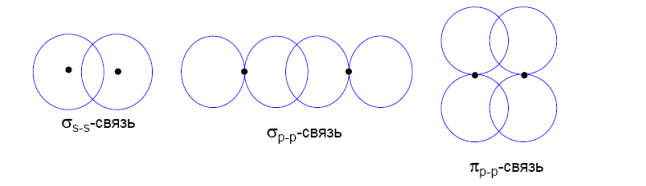
В большинстве неметаллов имеются только одинарные σ-связи. Наиболее прочными являются связи:
Наименее прочна связь F–F: 159 кДж/моль при длине 142 пм. Это одна из причин высокой химической активности фтора (наряду с молекулярным строением и большим сродством к электрону у атома).
В кислороде O2 – двойная связь, а в азоте N2 – очень прочная тройная (946 кДж/моль, 110 пм), что определяет его низкую реакционноспособность.
 2014-02-10
2014-02-10 540
540








