В некоторых условиях с телами могут происходить качественные превращения – их свойства могут существенно изменяться. Примерами таких явлений служат плавление – переход тела из твердого состояния в жидкое, и парообразование – переход жидкости в пар, растворение твердого тела. Все они качественно объясняются с молекулярной точки зрения. Внутренняя энергия состоит их кинетической энергии хаотического движения молекул и потенциальной энергии их взаимодействия. Кинетическая энергия с увеличением температуры меняется «плавно», а потенциальная энергия – скачкообразно, с перестройкой молекулярной структуры вещества, при которой резко меняются и его наблюдаемые свойства. Это может происходить и «само по себе», когда молекулы жидкости вылетают с ее поверхности (жидкость испаряется). Поскольку кинетическая энергия молекул жидкости сравнима по величине с потенциальной энергией их взаимодействия друг с другом, то более «быстрые» молекулы «вырываются» из сил притяжения остальных. Поместив кристаллы соли в воду, за счет сильного взаимодействия с молекулами растворителя, кристалл будет разрушаться, а молекулы соли переходить в раствор. Ясно, что все эти процессы активизируются при повышении температуры, когда средняя кинетическая энергия взаимодействующих молекул возрастает.
|
|
|
Под фазовым превращением будем подразумевать качественное изменение свойств вещества без воздействия других. Например, при нагревании льда при температуре 00 С он плавится – при этом химические свойства вещества не меняются, но оно переходит в другое фазовое состояние – жидкость. Под фазой мы будем подразумевать состояние вещества, когда оно отделяется от других фаз границей. Например, лед в воде при 00 С. Твердое тело и жидкость отделены видимой границей, на которой в состоянии равновесия фаз выполнено условие механического равновесия (граница неподвижна), и теплового равновесия (через границу не переносится тепло). Граница не является непрозрачной для молекул, происходит непрерывный переход молекул воды из жидкой фазы в твердую и обратно. В состоянии равновесия эти потоки вещества одинаковы, поэтому массы жидкой и твердой компонент не меняются. Представим, что мы начнем подавать энергию в эту систему. Тогда доля молекул жидкости в системе должна возрасти, ведь они имеют большую энергию, чем молекулы льда. Лед должен начать плавиться – поток молекул из твердой фазы в жидкую превысит обратный поток.
Мы знаем, что при повышении температуры тепловое движение активизируется. Можно предположить (и это будет верно), что температура связана со средней кинетической энергией молекул. Поэтому, при температуре 00 С у льда и воды эти энергии одинаковы. На что же идет дополнительная энергия при переходе льда в воду? Очевидно, на повышение потенциальной энергии молекул.
|
|
|
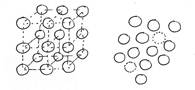
Напомню, что в кристалле Ek>> Wp, а в жидкости Wp~ Ek. Поскольку при одной температуре кинетические энергии равны, то потенциальная энергия молекулы в жидком состоянии больше. То есть, внутренняя энергия 1 кг льда при 00 С меньше, чем внутренняя энергия 1 кг воды при той же температуре. Поэтому, при плавлении необходимо сообщить льду дополнительную энергию в виде количества тепла.
Q=lm
Величина l - удельная теплота плавления льда. При температуре 00 С она равна 3.3*105 Дж/кг.
По способу перехода из твердого тела в жидкое вещества делятся на два типа. У веществ первого типа (кристаллические) этот переход происходит при определенной температуре. Пока переход не закончен, несмотря на непрерывную подачу тепла, температура не меняется (лед, металлы). Вещества второго типа (аморфные) при повышении температуры меняют свои свойства непрерывно в широком интервале температур, становятся менее твердыми и более текучими (воск, пластилин, стекло). Иногда тело нельзя перевести в жидкое состояние, поскольку оно химически разрушается при более низких температурах (дерево).
Переход кристаллического тела из жидкого в твердое состояние называется кристаллизацией. Она проходит при той же температуре, что и плавление.
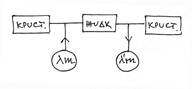
Из общих соображений сохранения энергии можно сделать вывод, что теплоты плавления и кристаллизации должны быть равны. l=l’. Действительно, при одной и той же температуре можно совершить замкнутый процесс, изображенный на рисунке. Конечное состояние такое же, как начальное. Если обозначенные теплоты не равны, то проводя цикл в нужном направлении, мы можем получать энергию из ничего. Поскольку это невозможно, то ml-ml’=0
 2014-02-10
2014-02-10 1862
1862








