 При охлаждении разбавленных растворов нелетучих веществ при определенной температуре начинает выкристаллизовываться растворитель, т.е. появляется твердая фаза, образованная чистым растворителем. Температуру замерзания раствора Т з можно определить как температуру, при которой раствор данного состава находится в равновесии с чистым твердым растворителем – точка О ¢. Из рисунка видно, что растворы замерзают при более низких температурах, чем чистый растворитель.
При охлаждении разбавленных растворов нелетучих веществ при определенной температуре начинает выкристаллизовываться растворитель, т.е. появляется твердая фаза, образованная чистым растворителем. Температуру замерзания раствора Т з можно определить как температуру, при которой раствор данного состава находится в равновесии с чистым твердым растворителем – точка О ¢. Из рисунка видно, что растворы замерзают при более низких температурах, чем чистый растворитель.
Разность между температурами замерзания чистого растворителя 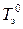 и раствора Т з при данном давлении зависит от концентрации растворенного вещества:
и раствора Т з при данном давлении зависит от концентрации растворенного вещества:
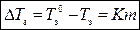 , (4)
, (4)
где m – моляльная концентрация раствора, моль/кг; К – криоскопическая константа растворителя.
Криоскопическая постоянная зависит от свойств растворителя и давления и не зависит от природы растворенного вещества:
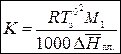 ,
,
где 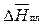 – мольная теплота плавления растворителя.
– мольная теплота плавления растворителя.
Значения К для различных растворителей приведены в справочной литературе, например, K (H2O) = 1,86 К×кг/моль.
|
|
|
Уравнение (4) – основной закон криоскопии для растворов неэлектролитов.
Для разбавленных растворов электролитов
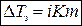 ,
,
где i – изотонический коэффициент.
Метод анализа, основанный на измерении понижения температуры замерзания, называется криоскопическим. Криоскопический метод также применяется для определения молярной массы, концентрации и степени диссоциации растворенного вещества и является более точным, чем эбуллиоскопический.
 2014-02-12
2014-02-12 445
445








