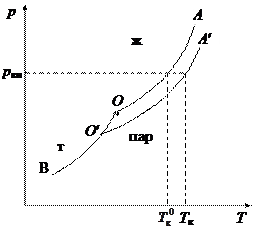
 Жидкость кипит, когда давление насыщенного пара над ней равно внешнему давлению. Поскольку давление насыщенного пара над раствором (кривая О¢А¢) меньше, чем над чистым растворителем (кривая ОА), растворы, по сравнению с чистым растворителем кипят при более высокой температуре. Разность между температурами кипения раствора Т к и чистого растворителя
Жидкость кипит, когда давление насыщенного пара над ней равно внешнему давлению. Поскольку давление насыщенного пара над раствором (кривая О¢А¢) меньше, чем над чистым растворителем (кривая ОА), растворы, по сравнению с чистым растворителем кипят при более высокой температуре. Разность между температурами кипения раствора Т к и чистого растворителя 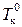 при одном и том же внешнем давлении p вн. Зависит от концентрации растворенного вещества:
при одном и том же внешнем давлении p вн. Зависит от концентрации растворенного вещества:
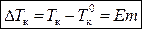 , (3)
, (3)
где m – моляльная концентрация раствора; E – эбуллиоскопическая постоянная растворителя, зависит только от природы растворителя и давления и не зависит от природы растворенного вещества:
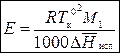 ,
,
где M 1 – молярная масса растворителя; 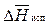 – мольная теплота испарения растворителя.
– мольная теплота испарения растворителя.
Эбуллиоскопическая постоянная растворителя является справочной величиной, например, для воды при p = 1 атм. E (H2O) = 0,52 К×кг/моль.
Моляльная концентрация раствора m равна числу моль растворенного вещества в 1000 г растворителя:
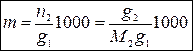 ,
,
где g 1, g 2 – масса (навеска) растворителя и растворенного вещества соответственно, г; n 2, M 2 – число моль и молярная масса растворенного вещества.
|
|
|
Уравнение (3) выражает основной закон эбуллиоскопии для растворов неэлектролитов.
Для растворов электролитов основной закон эбуллиоскопии имеет вид:
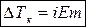 ,
,
где i – изотонический коэффициент – показывает, во сколько раз концентрация частиц (ионов, непродиссоциировавших молекул) превышает концентрацию растворенного вещества.
Изотонический коэффициент можно определить по формуле:
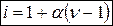 ,
,
где α – степень диссоциации электролита; ν – число ионов, образующихся при диссоциации одной молекулы.
Физико-химический метод анализа, основанный на измерении повышения температуры кипения растворов D T к, называется эбуллиоскопическим. Он применяется для определения концентрации растворенного вещества, его молярной массы, изотонического коэффициента и степени диссоциации электролита.
 2014-02-12
2014-02-12 459
459








