 Пусть раствор (зона II, см. рис.) и чистый растворитель (зона I) разделены полупроницаемой мембраной, пропускающей только молекулы растворителя. Такую систему можно рассматривать как гетерогенную двухфазую, а полупроницаемая мембрана является границей раздела фаз (система жидкость-жидкость).
Пусть раствор (зона II, см. рис.) и чистый растворитель (зона I) разделены полупроницаемой мембраной, пропускающей только молекулы растворителя. Такую систему можно рассматривать как гетерогенную двухфазую, а полупроницаемая мембрана является границей раздела фаз (система жидкость-жидкость).
В начальный момент времени химический потенциал чистого растворителя (фаза I) больше химического потенциала растворителя в растворе (фаза II):
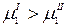 .
.
Следовательно, в системе будет протекать процесс выравнивания этих химических потенциалов. Растворитель будет проникать через мембрану в раствор, что приведет к разбавлению раствора.
Осмос – самопроизвольный переход растворителя (например, воды) из раствора меньшей концентрации в раствор большей концентрации через полупроницаемую мембрану.
Движущая сила осмоса – разность химических потенциалов растворителя по обе стороны от мембраны.
Осмос можно предотвратить, если к раствору (зона II) приложить избыточное давление.
Осмотическое давление – это давление, которое необходимо приложить к раствору для предотвращения осмоса и приведения системы в равновесие. Обозначается π.
|
|
|
Величина осмотического давления не зависит от природы мембраны и растворенного вещества и зависит только от концентрации растворенного вещества, т.е. является коллигативным свойством раствора:
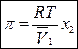 ,
,
где 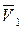 – мольный объем растворителя, м3/моль.
– мольный объем растворителя, м3/моль.
Для разбавленных растворов (n 1 >> n 2)
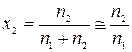 ,
,
тогда
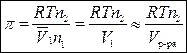 ,
,
где V 1, V р-ра – объем растворителя и раствора соответственно, м3.
Число моль растворенного вещества в единице объема раствора – молярная концентрация c, т.е. n 2/ V р-ра = c.
Тогда
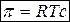 .
.
Для растворов электролитов:
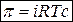 .
.
Явление осмоса лежит в основе различных методов очистки и разделения смесей, которые называются мембранными.
Если к раствору приложить давление, выше осмотического, равновесие нарушится – химический потенциал растворителя в растворе станет больше:
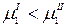 .
.
В этом случае происходит обратный осмос – растворитель будет переходить через полупроницаемую мембрану из фазы II в фазу I, что приведет к повышению концентрации растворенного вещества. Обратный осмос широко применяется для деминерализации воды.
Осмотическое давление играет важную роль в биологических процессах. Например, в организме животных некоторые типы клеток, например, эритроциты, содержат солевой раствор. Эти клетки ограничены плазматической мембраной. В водной среде эритроциты подвергаются осмосу, набухают и лопаются. Однако, если они попадают в более концентрированный раствор соли, клетки сморщиваются. Поэтому физиологический раствор, вводимый пациентам больниц в кровь, должен быть изотоничен крови.
|
|
|
Осмотическое давление имеет большое значение при консервировании пищевых продуктов путем добавления больших количеств соли или сахара (например, в производстве сгущенных молочных консервов): в растворах с высокой концентрации соли или сахара происходит сморщивание клеток микроорганизмов из-за потери воды (плазмолиз). Микроорганизмы становятся нежизнедеятельными.
 2014-02-12
2014-02-12 424
424







