1. Согласно закону действующих масс скорость прямой реакции равна:
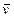 =
= 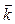 С4 (H2O)
С4 (H2O)
(концентрация твердой фазы в выражение скорости реакции не входит), а скорость обратной реакции равна:
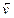 =
= 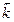 С4(H2)
С4(H2)
2. Обозначим концентрации реагирующих веществ:
С (H2O)= а, С (H2)= b,
тогда 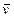 =
= 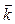 a4;
a4; 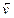 =
= 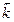 b4.
b4.
3. После увеличения давления, в системе в 3 раза, уменьшается объем системы в 3 раза, а концентрация всех газообразных веществ увеличивается в 3 раза, тогда С (H2O)]=3а, С (H2)=3b.
При новых концентрациях скорости прямой и обратной реакций:
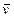 =
= 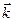 (3а)4 = 81
(3а)4 = 81 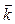 a4,
a4,
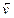 =
= 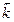 (3b)4 = 81
(3b)4 = 81 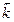 b4
b4
отсюда:
n = 81 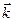 а4 / (
а4 / (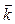 а4) = 81 - скорость прямой реакции увеличилась в 81 раз.
а4) = 81 - скорость прямой реакции увеличилась в 81 раз.
n = 81 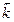 b4 /(
b4 /(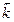 b4) = 81 - скорость обратной реакции увеличилась 81 раз.
b4) = 81 - скорость обратной реакции увеличилась 81 раз.
Зависимость скорости химической реакции от температуры выражается эмпирическим правилом Вант-Гоффа, согласно которому при увеличении температуры на 100 скорость большинства гомогенных реакций увеличивается в 2-4 раза. Число, показывающее, во сколько раз увеличивается скорость химической реакции при повышении температуры на 10 градусов,названо температурным коэффициентом 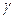 . Математически правило Вант-Гоффа можно выразить следующим образом:
. Математически правило Вант-Гоффа можно выразить следующим образом:
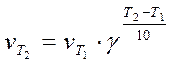 (3)
(3)
где v T2 и v T1 - скорости химической реакции при температурах Т2 и Т1. Множитель 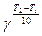 показывает увеличение скорости реакции при повышении температуры.
показывает увеличение скорости реакции при повышении температуры.
При концентрациях реагирующих веществ 1 моль/дм3 скорость химической реакции численно равна константе скорости k, поэтому правило Вант-Гоффа можно записать так:
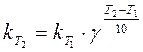 (4)
(4)
Это уравнение показывает, что константа скорости зависит от температуры так же, как и скорость процесса.
Правило Вант-Гоффа является весьма приближенным. Более точно зависимость константы скорости от температуры описывается уравнением Аррениуса:
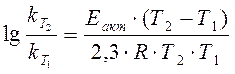 , (5)
, (5)
 где Еакт - энергия активации химической реакции, Дж/моль;
где Еакт - энергия активации химической реакции, Дж/моль;
R - универсальная газовая постоянная, R = 8,31 Дж/(моль∙К).
 2015-01-30
2015-01-30 589
589








