Состояние, при котором скорость прямой реакции равна скорости обратной реакции, называется химическим равновесием.
Равенство 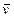 =
= 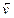 является кинетическим условием химического равновесия. В состоянии химического равновесия концентрации всех веществ постоянны и называются равновесными концентрациями. Так для реакции:
является кинетическим условием химического равновесия. В состоянии химического равновесия концентрации всех веществ постоянны и называются равновесными концентрациями. Так для реакции:
аА + вВ = сС + dD
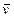 =
= 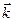 [A]a ∙ [B]b;
[A]a ∙ [B]b;
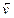 =
= 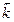 [C]c ∙ [D]d,
[C]c ∙ [D]d,
[...] - равновесные концентрации веществ, моль/ дм3.
Так как в состоянии равновесия 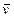 =
= 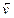 , то можно записать
, то можно записать
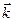 [A]a ∙ [B]b=
[A]a ∙ [B]b= 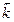 [C]c ∙ [D]d.
[C]c ∙ [D]d.
Преобразуем это равенство:
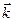 /
/ 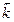 = К =
= К = 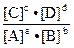
К -константа химического равновесия.
При заданной температуре константа равновесия химической реакции равна отношению констант скоростей прямого и обратного процессов. Константа химического равновесия К зависит от природы реагентов, температуры и не зависит от исходных концентраций веществ в системе. Константа химического равновесия равна отношению произведения равновесных концентраций продуктов реакции в степенях, соответствующих их стехиометрическим коэффициентам, к произведению равновесных концентраций исходных веществ также в соответствующих степенях.
Константа равновесия определяет глубину протекания процесса к моменту достижения равновесия. Чем больше эта величина, тем больше степень превращения реагентов в продукты.
Для гетерогенных систем в выражение константы равновесия входят только концентрации газообразных и растворенных веществ. Так, для реакций:
N2, г+3H2, г <=> 2NH3 г, 
3Fe203,к +CO,г <=>2Fe3О4,к + СО2, г, 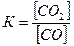 .
.
 2015-01-30
2015-01-30 383
383








