При решении задач этого раздела см. приложение, табл.6.
КОРРОЗИЯ - это самопроизвольно протекающий процесс окисления металлов в результате химического или электрохимического взаимодействия их с окружающей агрессивной средой.
Скорость химической коррозии обычно невелика, т.к. процесс окисления металла и восстановления частиц агрессивной среды идут на одной поверхности окисляющегося металла и мешают друг другу.
Электрохимическая коррозия протекает с образованием микрогальванических элементов (гальванопар), которые возникают при контакте разнородных металлов, контакте металла с 4 токопроводящим соединением металла или токопроводящим неметаллом, при контакте металла с раствором электролита с различной концентрацией в разных точках раствора, при неоднородных механических напряжениях металлического покрытия и т.п.
Во всех случаях анодом служит более активный металл, окисление которого идет по схеме
(А) Me - n 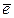 = Меn+
= Меn+
На поверхности катода, независимо от его химического состава, идет восстановление частиц агрессивной среды
|
|
|
в кислой среде: 2Н+ + 2 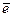 = Н2 ;
= Н2 ;
в нейтральной среде: 2Н2O + 2 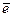 =Н2 +2OН-;
=Н2 +2OН-;
атмосферная коррозия: 2Н2O + O2 + 4 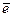 = 4OН-;
= 4OН-;
в щелочной среде: если металл может образовать амфотерные гидроксиды, то в щелочной среде идет дополнительная реакция
Me(OH)n + nOH- = MeOn-n +nH2O,
в противном случае коррозия сводится к обычной атмосферной коррозии.
 2015-01-30
2015-01-30 356
356








