Цель работы: приобретение навыков приготовления растворов различной концентрации из сухой соли или более концентрированного раствора.
При проведении химического анализа большинство аналитических операций проводится с растворами веществ в разных растворителях. Наиболее часто в аналитической химии применяют водные растворы. Каждое вещество характеризуется величиной растворимости.
Растворимостью называют максимальное количество вещества, способное раствориться в определенном количестве растворителя или растворе при данной температуре. Растворимость выражают количеством граммов растворенного вещества в 100 г, в 100 мл или в 1 л раствора; растворимость выражают также в молях на 1 л раствора.
В зависимости от количества вещества и растворителя и условий растворения можно получить пересыщение, насыщение и ненасыщение раствора. В перенасыщенных растворах содержание вещества в растворе превышает его растворимость при данной температуре. В насыщенных растворах концентрация вещества в растворе равна его растворимости. В ненасыщенных растворах концентрация вещества может увеличиваться до образования насыщенного раствора.
|
|
|
Растворы, содержащие очень много растворенного вещества, называют концентрированными, содержащие небольшое количество вещества – разбавленными. Концентрированный раствор может быть насыщенным и ненасыщенным и, наоборот, насыщенный раствор может быть очень разбавленным, если данное вещество плохо растворимо.
Пример 1. Вычислить растворимость BaCl2 в воде при 0 0С, если при этой температуре в 13,1 г раствора содержится 3,1 г BaCl2.
Решение.
Масса раствора BaCl2 13,1 г, следовательно, в 10 г растворителя при 0 0С содержится 3,1 г BaCl2. Растворимость BaCl2 при 00С равна 3,1/10 = 31 г.
Пример 2. Растворимость AlCl3 при 00С равна 44,9 г, а при 800С – 48,6 г. Сколько соли выпадает в осадок, если 540,0 г раствора хлорида алюминия охладить от 800 до 00С?
Решение.
а) при 800С 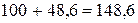 г
г
б) при 00С 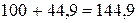 г.
г.
При охлаждении 148,6 г раствора хлорида алюминия в осадок выпадает
 г AlCl3
г AlCl3
если охладить 540 г раствора, то в осадок выпадет
148,6 г – 3,7 г
540,0 г – X г  г AlCl3.
г AlCl3.
Концентрация растворов и способы ее выражения.
Концентрация выражается количеством растворенного вещества к количеству раствора или растворителя. Различают:
 2015-01-07
2015-01-07 3549
3549
