Константа равновесия этой реакции равна:
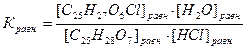
Для расчета константы равновесия необходимо определить равновесные концентрации всех веществ, участвующих в реакции.
Интенсивность окраски получившегося эфира будет зависеть от концентрации этого вещества, что даёт возможность применить для изучения равновесия колориметрический метод с использованием фотоэлектроколориметра.
Для определения равновесной концентрации C25H27O6Cl измеряют оптическую плотность полученного раствора и по калибровочной кривой находят концентрацию этого вещества. Равновесные концентрации С25Н28О7 и HCl рассчитывают по разности между исходными концентрациями этих веществ и равновесной концентрацией C25H27O6Cl. Равновесную концентрацию воды можно принять равной концентрации чистой воды, а именно 55,56 моль/л. Это допустимо, поскольку применяемые в работе растворы достаточно разбавлены.
По указанию преподавателя в мерную колбу вместимостью 50 мл отмерьте из бюреток заданные объёмы 0,001 М раствора С25Н28О7 и 0,01 М раствора HCl. Долейте колбу до метки водой и тщательно перемешайте раствор.
|
|
|
Налейте в фотоколориметрическую кювету на ¾ высоты приготовленный раствор, протрите торцевые стенки кюветы фильтровальной бумагой и определите оптическую плотность раствора.
По калибровочной кривой найдите равновесную концентрацию С25Н27О6Cl.
Результаты измерений сведите в таблицу.
| Объём раствора, мл | Оптическая плотность приготовленного раствора | Равновесная концентрация С25Н27О6Cl, моль/л | |
| С25Н28О7 | HCl | ||
По полученным данным рассчитайте:
1. Исходные молярные концентрации С25Н28О7 и HCl в анализируемом растворе.
2. Равновесные молярные концентрации С25Н28О7 и HCl.
3. Константу равновесия Кравн.
4. Стандартную энергию Гиббса реакции  G0.
G0.
Вопросы и задачи.
1. Какие реакции называют необратимыми, а какие обратимыми?
2. Что такое химическое равновесие?
3. Какими факторами можно вызвать смещение химического равновесия?
4. Что такое константа химического равновесия?
5. Напишите математическое выражение константы химического равновесия для следующих реакций:
а) 2 HBr(г) 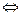 H2 (г) + Br2 (г);
H2 (г) + Br2 (г);
б) 2 H2 (г) + O2 (г) 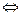 2 H2O (г)
2 H2O (г)
в) H2 (г) + CuO (к) 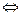 H2O (г) + Cu (к);
H2O (г) + Cu (к);
г) FeO (к) + CO (г) 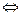 Fe (к) + CO2 (г);
Fe (к) + CO2 (г);
д) O3 (г) + NO (г) 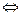 O2 (г) + NO2 (г).
O2 (г) + NO2 (г).
Как сместится равновесие в каждом из указанных случаев при увеличении давления?
6. При равновесии системы N2 + 3 H2 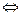 2 NH3 концентрации веществ равны СN
2 NH3 концентрации веществ равны СN 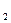 = 1,5 моль/л; CH
= 1,5 моль/л; CH 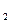 = 4,5 моль/л; CNH
= 4,5 моль/л; CNH 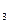 = 2 моль/л. Вычислите: а) исходные концентрации водорода и азота; б) константу химического равновесия.
= 2 моль/л. Вычислите: а) исходные концентрации водорода и азота; б) константу химического равновесия.
7. Как изменится скорость прямой и обратной реакции 2 NO2 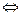 2 NO + O2, если концентрации в равновесной системе уменьшить в 3 раза? В каком направлении сместится химическое равновесие?
2 NO + O2, если концентрации в равновесной системе уменьшить в 3 раза? В каком направлении сместится химическое равновесие?
|
|
|
8. Сместится ли равновесие обратимой реакции H2 + I2 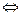 2 HI при повышении или понижении давления равновесной системы? Ответ обоснуйте.
2 HI при повышении или понижении давления равновесной системы? Ответ обоснуйте.
9. Как надо изменить давление и температуру, чтобы увеличить скорость прямой реакции А (к) + 2 В (г) 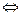 АВ2 (к), ΔН = -Q.
АВ2 (к), ΔН = -Q.
10.Рассчитайте константу равновесия реакции
С25Н28О7 + HCl 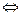 C25H27O6Cl + H2O,
C25H27O6Cl + H2O,
если для ее проведения смешали 12 мл 0,01 М раствора С25Н28О7 и 15 мл 0,01 М раствора HCl. Полученную смесь разбавили водой до 50 мл. Равновесная концентрация C25H27O6Cl оказалась равной 2,03∙10 -3 моль/л.
11. При некоторой температуре равновесие реакции получения йодоводорода из йода и водорода установилось при следующих концентрациях веществ:
CH 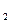 = 0,25 моль/л, СI
= 0,25 моль/л, СI 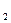 = 0,05 моль/л, CHI = 0,8 моль/л. Рассчитайте константу равновесия и исходные концентрации водорода и йода.
= 0,05 моль/л, CHI = 0,8 моль/л. Рассчитайте константу равновесия и исходные концентрации водорода и йода.
12. При взаимодействии уксусной кислоты с этиловым спиртом устанавливается равновесие, определяемое уравнением:
СН3СООН + С2Н5ОН = Н2О + СН3СООС2Н5.
Сколько молей эфира находится в системе в момент равновесия, если константа равновесия равна 4, исходная концентрация спирта равна 5 моль/л, а уксусной кислоты – 2 моль/л?
Работа № 6
 2015-01-07
2015-01-07 987
987








