Продифференцируем по температуре равенство 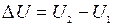 при V=const:
при V=const:
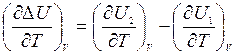 ,
,
так как 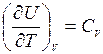 , то
, то 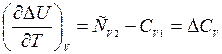 , где СV2 и СV1 – изохорные теплоёмкости в конечном и начальном состоянии.
, где СV2 и СV1 – изохорные теплоёмкости в конечном и начальном состоянии.
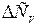 - изменение теплоёмкости системы в результате реакции.
- изменение теплоёмкости системы в результате реакции.
Например, для реакции:
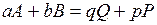
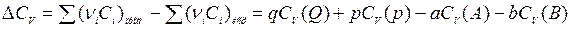 .
.
Дифференцируя по температуре равенство 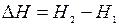 при
при 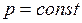 найдем:
найдем:
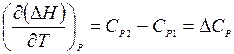 .
.
Полученные формулы выражают закон Кирхгофа: температурный коэффициент теплового эффекта процесса равен изменению теплоёмкости системы в результате протекания этого процесса.
Для получения теплового эффекта реакции от температуры в явном виде уравнение Кирхгофа необходимо проинтегрировать в заданном интервале температур от 298К до Т К:
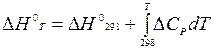 .
.
Теплоемкость сама зависит от температуры. Для расчетных целей в большинстве случаев эта зависимость аппроксимируется уравнениями в виде степенного ряда
С = а0 + а1Т + а2Т2+….
или
С = а0 +а1Т +а'2 Т-2+….
где а0, а1, а2, а'2 –коэффициенты, зависящие от природы вещества.
Первый степенной ряд обычно справедлив для органических веществ, а второй - для неорганических.
Во многих случаях достаточная точность расчета достигается использованием только линейной части уравнений, т. е.
С = а0 + а1Т
Коэффициенты уравнения для некоторых веществ табулированы в справочнике физико-химических величин.
Кроме истинной, иногда в расчетах используют среднюю теплоемкость в интервале температур от Т1 до Т2, обозначаемую 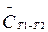 .
.
Подставим в формулу температурную зависимость теплоёмкости, выражаемую степенным рядом вида для неорганических веществ:
ΔС0р = Δа + ΔbT + ΔcT2 + ΔdT3 + Δc′ 1/T2….
Для получения зависимости теплового эффекта химических реакции от температуры в явном виде, уравнение Кирхгофа необходимо проинтегрировать в заданном интервале температур от 298 К до Т К.
После подстановки степенного ряда и интегрирования получим развернутое уравнение Кирхгофа:
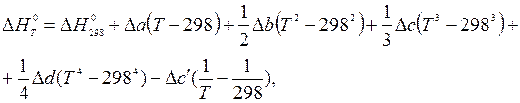
где ΔН0298 - стандартный тепловой эффект реакции при 298 К; Δа, Δb, Δc, Δd, Δc′,- изменение коэффициентов в уравнении зависимости теплоёмкости для различных веществ.
Величины ΔН0298, Δа, Δb, Δc, Δd, Δc′ рассчитывают по закону Гесса, используя табличные данные, приведённые в справочнике физико–химических величин.
 2014-05-17
2014-05-17 5037
5037
