В термодинамике функция называется характеристической,если ее значения и значений ее производных разного порядка достаточно для полного описания системы, т. е. для выражения в явной форме любого термодинамического свойства системы.
Математический аппарат термодинамики строится на основе объединенного уравнения первого и второго законов термодинамики для обратимых процессов. Для систем с постоянным составом
dU = TdS – pdV
Это уравнение Дж. Гиббс назвал фундаментальным уравнением термодинамики.
В качестве независимых переменных здесь выступают S, V, т. е. те величины, которые использованы в качестве «координат» при расшифровке теплоты и различного вида работ в первом и втором законах термодинамики. Их называют естественными независимыми переменными для внутренней энергии. При такой записи внутренняя энергия рассматривается как функция ее естественных переменных U = f (S, V).
Полный дифференциал функции двух переменных u(x,y) находят по формуле
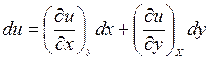
В результате сопоставления фундаментального уравнения с полным дифференциалом функции для внутренней энергии можно получить
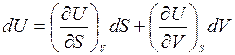
Откуда следует, что
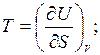
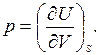
Практическое применение полученных частных производных по переменным V и S неудобно. Это относится, прежде всего, к энтропии, которую нельзя измерить. Не очень удобной переменной является объем при работе с конденсированными фазами. Поэтому в термодинамике используют достаточно просто связанные с внутренней энергией вспомогательные функции, вводимые соотношением
Ф = U ± ∑ху,
где U - внутренняя энергия; ∑ху – сумма произведений термодинамических параметров состояния системы.
В математике производимые таким образом замены переменных носят название преобразований Лежандра. С помощью таких преобразований можно менять ролями зависимые и независимые переменные в каждом из слагаемых фундаментального уравнения.
Функции Ф, так же как и U, являются функциями состояния.
Одна из таких функций - энтальпия (Н = U + pV) — оказалась весьма удобной при анализе тепловых эффектов химических реакций. Продифференцировав это выражение и заменив dU по уравнению полного дифференциала, получим
dH = TdS + Vdp
где независимой переменной является давление, а не объем. Для энтальпии естественными переменными являются S и р.
Таким образом, чтобы поменять ролями переменные, надо прибавить к рассматриваемой функции или вычесть из нее произведение тех параметров, которые меняются ролями.
Из других вспомогательных функций в термодинамике наибольшее значение приобрели энергия Гельмгольца, или «свободная энергия»,
F = U - TS
и энергия Гиббса, или «свободная энтальпия»
G = U -TS+pV.
Соотношение между величинами известных нам термодинамических функций можно представить в виде схемы
Связь между термодинамическими функциями и основными параметрами системы p, V, и T представлена рисунком:
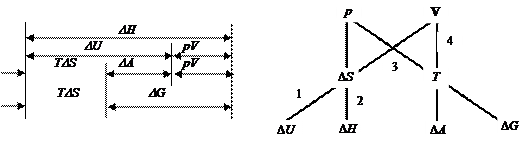 |
Каждая из четырех прямых характеризует связь между тремя величинами, две из которых являются термодинамическими функциями состояния. При постоянстве двух других третья величина определяет условия самопроизвольного и равновесного процесса:
| № прямой | Постоянные величины | Условия самопроизвольного процесса | Условия равновесного процесса |
| U, V | DS > 0 | DS = 0 (max S) | |
| S, V | DU < 0 | DU = 0 (min U) | |
| H, p | DS > 0 | DS = 0 (max S) | |
| S, p | DH < 0 | DH = 0 (min H) | |
| T, p | DG < 0 | DG = 0 (min G) | |
| T, V | DA < 0 | DA = 0 (min A) |
Все функции имеют размерность энергии. Поскольку абсолютное значение внутренней энергии (а, следовательно, и других вспомогательных функций) определить нельзя, все отрезки, выражающие их величину, даны с одинаковым разрывом, соответствующим началу отсчета внутренней энергии. График справедлив для определенного состояния системы. При изменении условий величины составляющих отрезков изменяются.
Дифференцируя F и G и заменяя dU, получим
dF = -SdT - pdV
dG = -SdT + Vdp
Сопоставляя последние уравнения с полным дифференциалом функций F(T,V) и G(T,p) получим

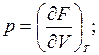
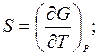
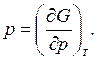
Полученные соотношения определяют энтропию как частную производную от функций F или G по температуре. Использование функций F и G позволяет для изотермических процессов не рассматривать энтропию в числе контролируемых на опыте величин.
Особое значение функций F и G определяется также и тем, что, изменение этих функций при постоянстве Т и V или Т и р соответственно связано с работой, которую можно получить при обратимом проведении процесса.
1) При Т и V = const:
F = U TS, следовательно, ∆F = ∆U T∆S, A 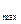 = - ∆F.
= - ∆F.
2) При Т и р = const:
G = H TS или G = U TS + pV.
Учитывая, что U = F + TS, формулу для энергии Гиббса можно переписать в виде: G = F + pV.
Для изменений, проходящих в изобарном процессе:
DG = DF + pDV
или
DG = DH TDS.
Последняя формула позволяет по тепловому эффекту или изменению энтальпии реакции, а так же соответствующему изменению энтропии системы рассчитать изменение изобарного потенциала и максимальную работу А 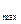 :
:
А' 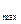 = -
= - 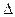 G,
G,
Откуда согласно предыдущим выражениям
А′ 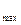 = A
= A 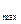 pDV,
pDV,
т.е. максимально полезная работа изобарно–изотермического процесса равна максимально полезная работа изохорно–изотермического процесса за вычетом работы против внешнего давления.
 2014-05-17
2014-05-17 8275
8275
