Теплота образования химических соединений из простых веществ (∆H0f,298). Использование величин ∆H0f,298 для вычисления тепловых эффектов реакций
Изменение энтальпии может характеризовать с энергетической стороны не только реакцию, но и химическое соединение, полученное в этой реакции. Поскольку синтезировать один и тот же продукт можно различными способами, для однозначной характеристики его термодинамических свойств применяют только такую реакцию, где в качестве исходных веществ участвуют простые вещества в своих термодинамически устойчивых (или стандартных) состояниях.
Термодинамически устойчивым состоянием простого вещества, существующего при T = 298К в твердом виде, считают его чистый кристалл под давлением 1 атм = 101325 Па. Если простое вещество может существовать при 298К в двух и более аллотропных формах, термодинамически стабильным состоянием будет его наиболее устойчивая форма. Так, термодинамически устойчивым состоянием углерода будет графит, а не алмаз.
Если простое вещество при 298 К представляет собой жидкость, как, например, бром или ртуть, его термодинамически устойчивым состоянием считают чистую жидкость под давлением 1 атм.
|
|
|
Если простое вещество при 298 К представляет собой газ (Н2, O2, Не и т. д.), то его термодинамически устойчивым состоянием будет газ с собственным давлением 1 атм.
Поскольку в определение Н входит U, то абсолютное значение энтальпии системы (или какого-то вещества) неизвестно. Поэтому энтальпию вещества характеризуют стандартными энтальпиями образования и сгорания.
Cтандартная энтальпия образования∆H°f (formation - образование) — это тепловой эффект реакции образования 1 моль вещества из простых веществ или элементов, отвечающих их наиболее устойчивому состоянию:
простые вещества → X.
Согласно определению стандартной энтальпии образования вещества стандартная энтальпия образования простого вещества будет равна нулю. Это отправная точка отсчета, от которой отсчитывается энтальпия образования сложных веществ и термодинамически неустойчивых простых веществ.
Стандартная энтальпия сгорания ∆H0с (сombustum - сгорание) – это теплота реакции сгорания вещества до высших оксидов (с максимальной степень» окисления) при стандартных условиях:
Х + О2 →высшие оксиды
Для указанных оксидов принимается, что ∆H0с = 0.
Величины ∆H0с определены для очень многих веществ экспериментальным способом — путем сжигания вещества в калориметрической «бомбе» и. измерения выделяющейся теплоты. Зная ∆H0с, можно вычислить и ∆H0f. Эти значения (∆H0с и ∆H0f) содержатся во многих справочных таблицах, в частности, в курсе общей химии.
|
|
|
Для получения формул, показывающих, как пользоваться этими величинами, обратимся к простейшей реакции:
| A | → | B |
| ∆H°r |
Здесь ∆H°r – теплота реакции.
Теплота результирующего превращения не изменится (по закону Гесса), если его провести одним из двух таких способов:
| A | → | простые вещества | → | B |
| -∆H°f (А) | ∆H°f (В) |
| A | → | оксиды | → | B |
| ∆H°с (А) | -∆H°с (В) |
Отсюда получаем:
∆H°r = -∆H°f (А) + ∆H°f (В)= ∆H°с (А) - ∆H°с (В)
Обобщение этих выражений для произвольных реакций приводит к формулам:
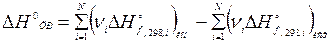
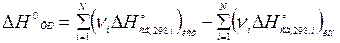
Здесь νi- стехиометрические коэффициенты перед соответствующими веществами в уравнении реакции.
Таким образом, для расчета теплоты реакции по энтальпиям образования cледует из суммы энтальпий продуктов вычесть сумму энтальпий реагентов.
А при использовании энтальпий сгорания — наоборот, из суммы энтальпий реагентов вычесть сумму энтальпий продуктов.
Пример расчета по этим формулам.
Спиртовое брожение глюкозы у дрожжей:
| С6Н12О6(в) | → | 2С2Н5ОН | + | 2С2Н5ОН | |
| ∆H°f | -1263 | -277 | -394 |
∆H°r = 2 (-277)+ 2 (-394)-(-1263) =-79 кДж/моль.
 2014-05-17
2014-05-17 1611
1611








