Процессы парообразования и конденсации широко распространены в химической технологии. Важной теплофизической характеристикой при расчете процессов перегонки, выпарки, ректификации, кипения и сушки является теплота парообразования r.
Для исследования термодинамических процессов, происходящих с реальными газами, большое значение имеют pv - и Ts -диаграммы (рис. 1 и 2).
Кривые a1b1c1d1, a2b2c2d2 … на pv -диаграмме соответствуют процессу расширения вещества при t = const, а кривые ab1c1f1, ab2c2d2 … на Ts -диаграмме – процессу нагревания вещества при p = const.
 | |||||||||||||||||
 | |||||||||||||||||
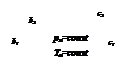 | |||||||||||||||||
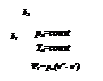 | |||||||||||||||||
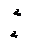 | |||||||||||||||||
| |||||||||||||||||
| |||||||||||||||||
| |||||||||||||||||
| |||||||||||||||||
| |||||||||
 | |||||||||
 | |||||||||
 | |||||||||
|
На обеих диаграммах точки b1, b2,… соответствуют началу процесса парообразования и образуют нижнюю пограничную кривую – кривую кипящей жидкости (х = 0). На этих же диаграммах в точках с1, c2,… процесс парообразования завершается и данные точки образуют верхнюю пограничную кривую, соответствующую сухому насыщенному пару (х = 1). Точки d1, d2,… (рис. 1) и f1, f2,… (рис. 2) соответствуют состоянию перегретого пара, а точка а – жидкости. Степень сухости:
|
|
|
х = 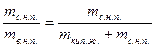 ,
,
где 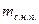 - масса сухого насыщенного пара;
- масса сухого насыщенного пара;
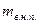 - масса влажного насыщенного пара;
- масса влажного насыщенного пара;
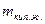 - масса кипящей жидкости.
- масса кипящей жидкости.
|
Таким образом, на обеих диаграммах можно выделить три характерные области состояний:
· область жидкого состояния – расположена левее кривой кипящей жидкости х = 0, t < tн;
· область влажного насыщенного пара – двухфазное состояние, где пар и жидкость находятся в равновесии и имеют одинаковые рн и tн. Эта область расположена между пограничными кривыми х = 0 и х = 1, т.е. в этой области 0 < x < 1;
· область перегретого пара – расположена правее кривой сухого насыщенного пара, х = 1, t>tн при данном давлении.
Переход вещества из одной фазы в другую называется фазовым переходом. Вещества, находящиеся в разных агрегатных состояниях, имеют различные физические свойства. Это различие объясняется характером межмолекулярного взаимодействия.
|
|
|
Количество теплоты, которое необходимо подвести к 1 кг жидкости для перехода её в пар в изобарно-изотермическом (рн и tн = const) процессе называется теплотой парообразования r, кДж/кг. Она расходуется на работу расширения 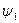 и на преодоление сил межмолекулярного взаимодействия
и на преодоление сил межмолекулярного взаимодействия 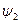 :
:
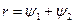 , (1)
, (1)
где 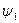 - внешняя составляющая теплоты парообразования, она рассчитывается как
- внешняя составляющая теплоты парообразования, она рассчитывается как
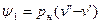 , (2)
, (2)
где 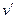 и
и 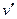 - удельные объемы кипящей жидкости и сухого насыщенного пара соответственно;
- удельные объемы кипящей жидкости и сухого насыщенного пара соответственно;
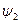 - внутренняя составляющая теплоты парообразования.
- внутренняя составляющая теплоты парообразования.
На pv- диаграмме (рис. 1), как следует из уравнения (2), величина 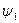 показана заштрихованной площадкой. На Ts -диаграмме (рис.2) заштрихованной площадкой показана величина теплоты парообразования, которая может быть рассчитана как:
показана заштрихованной площадкой. На Ts -диаграмме (рис.2) заштрихованной площадкой показана величина теплоты парообразования, которая может быть рассчитана как:
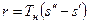 , (3)
, (3)
где 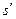 и
и 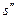 - энтропия кипящей жидкости и сухого насыщенного пара соответственно,
- энтропия кипящей жидкости и сухого насыщенного пара соответственно, 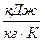 ;
;
Тн - температура насыщения, К.
Из pv- и Тs -диаграмм видно, что с увеличением давления р точки b1, b2,… на нижней пограничной кривой сближаются с точками с1, с2, …на верхней пограничной кривой и в критической точке они сходятся. Так, для воды критические параметры в точке К имеют следующие значения: ркр. = 22,13 МПа, tкр. = 374,2 °С, vкр. = 0,00326 м3/кг.
Выше критической точки К при p > pкр . и Т > Ткр . двухфазного состояния не наблюдается. Жидкая фаза находится под весьма большим внутренним давлением. Фактором, определяющим интенсивность межмолекулярных взаимодействий, является не давление, а температура. С ростом температуры и давления теплота парообразования r уменьшается, а в критической точке r = 0,  и
и 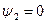 , т.к. в этом состоянии исчезает различие между жидкостью и ее паром и процесс парообразования отсутствует.
, т.к. в этом состоянии исчезает различие между жидкостью и ее паром и процесс парообразования отсутствует.


|
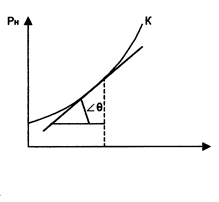 Опытным путем было установлено, что каждому давлению р соответствует определенная температура насыщения tнас . (кипения) данной жидкости, являющаяся одновременно температурой насыщения пара, с которым жидкость находится в равновесии. Кривая зависимости
Опытным путем было установлено, что каждому давлению р соответствует определенная температура насыщения tнас . (кипения) данной жидкости, являющаяся одновременно температурой насыщения пара, с которым жидкость находится в равновесии. Кривая зависимости 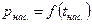 называется кривой насыщения, рис. 3.
называется кривой насыщения, рис. 3.
|

|

|
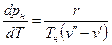 , (4)
, (4)
где 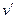 ,
, 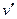 - удельные объемы соответственно жидкости и сухого насыщенного пара на линии насыщения при Тнас. и рнас ., м3/кг.
- удельные объемы соответственно жидкости и сухого насыщенного пара на линии насыщения при Тнас. и рнас ., м3/кг.
Поскольку 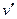 >
> 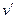 , из уравнения (4) следует, что при фазовом переходе «жидкость-пар» производная
, из уравнения (4) следует, что при фазовом переходе «жидкость-пар» производная 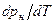 всегда больше нуля, т.е. с ростом давления температура насыщения увеличивается.
всегда больше нуля, т.е. с ростом давления температура насыщения увеличивается.
Уравнение Клапейрона-Клаузиуса (4) имеет важные достоинства. Во-первых, оно устанавливает связь между калорическими 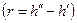 и термодинамическими (р, v, Т) параметрами. Во-вторых, дает связь между параметрами жидкого (
и термодинамическими (р, v, Т) параметрами. Во-вторых, дает связь между параметрами жидкого (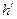 ,
, 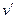 ) и парообразного (
) и парообразного (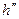 ,
, 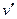 ) состояний.
) состояний.
Первое из этих достоинств уравнения (4) в данной работе используется для определения теплоты парообразования r по кривой насыщения, полученной по результатам измерения термодинамических параметров рн и tн.
 2015-02-24
2015-02-24 794
794








