Щелочность почвенного раствора зависит от наличия в нем свободных гидроксильных ионов (ОН–). Вызывается она главным образом находящимися в почвенном растворе карбонатами и гидрокарбонатами щелочных и щелочно-земельных металлов, которые при взаимодействии с водой образуют слабые кислоты и сильные основания, определяющие щелочную реакцию. Щелочность почвенного раствора может вызываться также гидролитически щелочными солями кремневой и органических кислот.
Установление щелочности необходимо для разработки мероприятий по ее устранению.
Принцип определения щелочности, вызывающейся нормальными карбонатами. Некоторый объем водной вытяжки титруют серной кислотой в присутствии фенолфталеина:
2Na2CO3 + H2SO4 = 2NaHCO3 + Na2SO4.
Появление в результате этой реакции в растворе иона HCO3-приводит к снижению рН (ниже 8,2) и обесцвечиванию фенолфталеина. При этом, согласно уравнению реакции, сода оттитровывается лишь наполовину, т. е. до образования бикарбоната.
Материалы и оборудование: аналитические весы, почва (воздушно сухая), ротатор.
|
|
|
Реактивы: Фенолфталеин, 0,01 н. раствор H2SO4, метилоранж.
Ход анализа. К 25—50 мл водной вытяжки в конической колбочке прибавляют 1—2 капли фенолфталеина и при появлении розовой окраски (что указывает на присутствие нормальных карбонатов) жидкость титруют 0,01 н. раствором H2SO4 до исчезновения окраски. Для большей точности определения конца титрования рядом с колбочкой, в которой проводят титрование, ставят такую же колбочку с таким же количеством вытяжки, но без фенолфталеина (свидетель). Титруют до тех пор, пока окраска жидкости в колбочке с фенолфталеином не сравняется с окраской жидкости в колбочке без индикатора.
Вычисление результатов анализа. Расчеты ведут по формуле
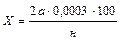 ,
,
где X – количество ионов СО32– % к массе почвы;
а – количество 0,01 н. раствора H2SO4, израсходованного на титрование, мл;
2 – коэффициент, указывающий, что число миллилитров кислоты надо удвоить, так как при титровании обесцвечивание раствора наступает, как только карбонат перейдет в бикарбонат, т. е. когда фактически оттитровывается лишь половина карбонат-ионов;
0,0003 – граммы СО32–, соответствующие 1 мл 0,01 н. H2SO4;
н – навеска почвы, отвечающая объему вытяжки, взятой для титрования, г;
100 – для пересчета результатов в проценты.
Принцип определения общей щелочности. Метод заключается в титровании вытяжки кислотой в присутствии индикатора – метилоранжа, т. е. до рН 4,4:
Са (НСО3)2 + H2SO4 = 2Н20 + 2СО2 + CaSO4.
Ход анализа. После определения щелочности от нормальных карбонатов, а при их отсутствии сразу же после добавления фенолфталеина (если не появилась окраска) в ту же колбочку (или в другую — с новой порцией вытяжки) приливают две капли метилоранжа и титруют 0,01 н. раствором H2SO4 до возникновения розовой окраски. Для точности титрования колбочку ставят на лист белой бумаги, а рядом с ней помещают другую колбочку такого же объема и с тем же количеством вытяжки и индикатора. Титруют жидкость до слабого ее порозовения.
|
|
|
Вычисление результатов анализа. Определяя общую щёлочность, суммируют количество кислоты, израсходованной при титровании вытяжки в колбочках как с фенолфталеином, так и с метилоранжем. Расчет ведут по формуле
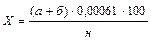 ,
,
где X – общая щелочность, % НСО3– к массе почвы;
а – количество 0,01 н. H2SO4, пошедшей на титрование вытяжки с фенолфталеином, мл;
б – количество той же кислоты, затраченное на титрование такого же объема с метилоранжем, мл;
0,00061 – количество НСО3–, соответствующее 1 мл 0,01 н. раствора H2SO4, г;
н – навеска почвы, отвечающая объему вытяжки, взятой для титрования, г;
100 – для пересчета результатов в проценты.
 2015-02-27
2015-02-27 3190
3190








