Возникновение электрического заряда на поверхности играет чрезвычайно большую роль в физической химии дисперсных систем и поверхностных явлений. Явления, связанные с взаимодействием электрического поля с зарядом жидкости или с поверхностным зарядом диспергированных частиц твердого тела, получили название электрокинетических.
Движение жидкости относительно стенок твердых тел при наложении электрического поля получило название электроосмос. Движение твердых частиц под воздействием электрического поля названо электрофорез. Оба эти явления были впервые открыты и описаны в 1809 г. профессором МГУ Ф.Ф.Рейсом.
Если в нижнюю зону U-образной трубки поместить пористое тело или пучок большого числа стеклянных капилляров, заполнить оба колена U-образной трубки сильно разбавленным водным раствором электролита и пропускать ток, то жидкость будет перемещаться из одного колена в другое, т.е. будет осуществлять явление электроосмоса. Если пористая масса – стекло, то вода будет перемещаться к катоду. Объясняется это тем, что поверхность стекла адсорбирует гидроксид-ионы. В водном растворе остаются свободные ионы гидроксония, которые двигаются по направлению к катоду, увлекая за собой полярные молекулы воды.
|
|
|
Электрофорез в опытах рейса был осуществлен следующим образом: частицы диспергированной в воде глины передвигались при наложении электрического поля к аноду. Следовательно, частицы глины несут отрицательный заряд. Диспергированные частицы приобретают заряд вследствие избирательной адсорбции ионов.
80.Равновесие Гиббса-Доннана и его значение для поддержания постоянного солевого состава клетки
Для систем, в состав которых входят высокомолекулярные электролиты, диффузии которых препятствует мембрана и низкомолекулярные электролиты, процесс диффузии в целом протекает необычно. Эта особенность, приводящая к неравномерному распределению низкомолекулярных электролитов, получила теоретическое обоснование в работах Доннана.
Рассмотрим типичную модель системы, содержащие полиэлектролит и раствор низкомолекулярного электролита. Пусть это будет золь, отделенный от раствора низкомолекулярного электролита мембраной, непроницаемой для полиэлектролита и проницаемой для низкомолекулярного электролита. Такими полиэлектролитами могут быть белки, нуклеиновые кислоты. Пусть полиионы R-несут отрицательный заряд, а противоположно заряженный Na+является общим для ВМС (высокомолекулярных соединений) и НМС (низкомолекулярных соединений). Чтобы упростить расчет примем, что объемы А и Б двух частей системы равны и равны единице, а С1.и С2 – исходные концентрации.
|
|
|
Из условия сохранения электронейтральности через мембрану должно пройти в любом направлении равное количество отрицательно и положительно заряженных ионов. Поскольку ионы R-не могут диффундировать через мембрану, возможна только диффузия ионов Na+и Cl-из части Б в часть А. Диффузия будет протекать до тех пор, пока не установится равновесие, изображенное схемой:
для момента равновесия можно записать:
для ионов натрия 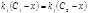 ,
,
для ионов хлора 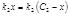 ,
,
где k1и k2– коэффициент пропорциональности. Перемножив почленно левые и правые части уравнений, после преобразований получим:
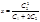 . Из уравнения (2.6) следует, что при очень малой концентрации коллоидов (полиионов) в части системы А, когда С1значительно меньше, чем С2, т.е. С1С2, в знаменателе можно пренебречь величиной С1. В этом случае получим:
. Из уравнения (2.6) следует, что при очень малой концентрации коллоидов (полиионов) в части системы А, когда С1значительно меньше, чем С2, т.е. С1С2, в знаменателе можно пренебречь величиной С1. В этом случае получим: 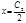 .
.
Это значит, что при малой концентрации коллоидов низкомолекулярный электролит равномерно распределится по всему объему, по обе стороны мембраны.
Наоборот, очень большая концентрация полиионов в левой части системы будет препятствовать диффузии, HMC – ионов Na+и Cl-из правой части системы в левую. Действительно, если С1 С2, то в знаменателе можно пренебречь членом 2С2 и получим:
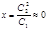 . (2.18). Если в состоянии равновесия при С1 С2ввести хлорид натрия в левую часть системы, то равновесие нарушится и ионы Na+и Cl-в соответствии со вторым законом термодинамики будут диффундировать в правую часть системы, т.е. от меньшей концентрации к большей. Равновесие Доннана имеет большое биологическое значение. Так, в плазме крови содержится 7-9 % белков. Однако кровь непосредственно не соприкасается с клетками. С ними соприкасается лимфа, заполняющая межклеточное и межтканевое пространство. Солевой состав лимфы почти не отличается от крови, но содержание белков в лимфе всего 0,01-0,03%. Именно поэтому в соответствии с (2.3) при введении соли в кровяную плазму лишь малая часть ее переходит в клетку, в которой поддерживается стабильный солевой состав.
. (2.18). Если в состоянии равновесия при С1 С2ввести хлорид натрия в левую часть системы, то равновесие нарушится и ионы Na+и Cl-в соответствии со вторым законом термодинамики будут диффундировать в правую часть системы, т.е. от меньшей концентрации к большей. Равновесие Доннана имеет большое биологическое значение. Так, в плазме крови содержится 7-9 % белков. Однако кровь непосредственно не соприкасается с клетками. С ними соприкасается лимфа, заполняющая межклеточное и межтканевое пространство. Солевой состав лимфы почти не отличается от крови, но содержание белков в лимфе всего 0,01-0,03%. Именно поэтому в соответствии с (2.3) при введении соли в кровяную плазму лишь малая часть ее переходит в клетку, в которой поддерживается стабильный солевой состав.
 2015-02-04
2015-02-04 2163
2163








