Растворы высокомолекулярных соединений часто рассматриваются в коллоидной химии в разделе “Лиофильные золи”. Но они принципиально отличаются от коллоидных систем. Растворы ВМС (молекулярные коллоиды) представляют собой гомогенные термодинамически устойчивые обратимые системы, образующиеся самопроизвольно при растворении ВМС в хорошо взаимодействующим с ним растворителе. Это истинно молекулярные растворы. С коллоидными системами их объединяет размер частиц. Молекулы ВМС – макромолекулы. С этим связаны схожесть оптических свойств, малая скорость диффузии, низкое осмотическое давление. В определенных условиях Например, при замене растворителя) ВМС способны образовывать не только истинные растворы, но и типично коллоидные системы – золи.
Тем не менее по ряду свойств, из-за больших размеров макромолекул, растворы ВМС приближаются к коллоидным растворам, поэтому изучаются в курсе коллоидной химии.. В табл. 23 приведены некоторые свойства растворов ВМС в сопоставлении со свойствами истинных и коллоидных растворов.
Процесс растворения ВМС отличается от растворения низкомолекулярных веществ. Растворению полимера предшествует набухание.При набухании молекулы растворителя интенсивно проникают в твердый полимер, образуя с ним прочные сольватные комплексы (студни). Студень, по существу – насыщенный раствор низкомолекулярной жидкости в полимере, и его можно рассматривать как систему, состоящую из пространственной сетки, из частично взаимосшитых макромолекул и из молекул растворителя, которые заполняют пространство между макромолекулами. В студне дисперсной фазой служит растворитель, молекулы которого распределены в растворяемом ВМС, как в дисперсионной среде.
Набухание – проникновение молекул растворителя в среду высокомолекулярного соединения и связанное с этим увеличение его массы и объема.
Таблица 23
Свойства растворов высокомолекулярных соединений
| Показатель | Растворы | ||
| ВМС | коллоидные | истинные | |
| Образование | самопроизвольное | несамопроиз-вольное | самопроизвольное |
| Термодинамическая устойчивость | устойчивы | неустойчивы | устойчивы |
| Обратимость | обратимые | необратимые | обратимые |
| Гетерогенность | гомогенные | гетерогенные | гомогенные |
| Размеры частиц (радиус), м | 10-9…10-7 | 10-9…10-7 | 10-11 |
| Оптические свойства | светорассеяние | светорассеяние | Поглощение и пропускание |
| Диффузия | меленная | медленная | быстрая |
| Отношение к диализу | не диализуется | не диализуется | диализуется |
В зависимости от условий полимер может увеличивать свои массу и объем в 10-15 раз. Набухание может быть неограниченным, когда конечным его результатом является переход полимера в раствор (растворение), и ограниченным, если набухание не доходит до растворения полимера, полимер переходит в состояние студня. Примером ограниченно набухающего полимера является вулканизированный каучук, в котором мостиками служат атомы серы или полярные группировки.
Количественной набухания является степень набухания α, которая может иметь массовое или объемное выражение.
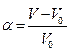 или
или 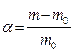
где V0 и V, m0 и m - соответственно объемы и массы исходно и набухающего полимера.
Процесс набухания зависит от многих факторов: природы ВМС и растворителя, температуры, давления паров растворителя, добавок электролитов и др. Набухание играет большую роль в жизнедеятельности организмов.
Свойства растворов ВМС.
Высокомолекулярные вещества могут образовывать истинные или коллоидные растворы (дисперсии). Характер раствора зависит от сродства ВМС к растворителю. В растворителях, полярность которых соответствует полярности ВМС, происходит растворение с образованием молекулярных растворов (например, агар-агар и желатин в воде).
Под влиянием электролитов и нерастворителей происходит процесс выделения ВМС из раствора - высаливание. Внешне этот процесс сходен с коагуляцией, т. к. ВМС выделяются в виде хлопьев, волокон и творожистых осадков. Однако если для коагуляции гидрофобных золей под действием электролита требуются незначительные количества электролита и процесс коагуляции часто необратим, то на разрушение водного раствора ВМс затрачивается большая концентрация электролита и наблюдается неподчинение правилу Шульце-Гарди. Высаливание - обратимый процесс. В основе механизма высаливания ВМС лежит процесс дегидратации. Высаливающее действие электролита не связано с зарядом иона, а определяется лишь его способностью к гидратации. Чем больше воды требуется для гидратации иона, тем меньше ее остается на растворимость ВМС и легче происходит высаливание.
Более сильный высаливающий эффект вызывают анионы, которые по силе высаливающего действия располагаются в лиотропный ряд:
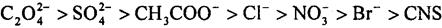
В аналогичный ряд, но с меньшим воздействием на высаливание, располагаются и катионы:
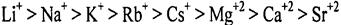
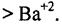
Высаливающая активность ионов связана с их радиусом и способностью к сольватации. Чем меньше радиус иона, тем больше его сольватирующая способность из-за большей плотности заряда на поверхности иона.
В некоторых случаях при высаливании наблюдается коацервация. Она заключается в расслоении раствора полимера на два слоя: раствор ВМС в растворителе и раствор растворителя в ВМС. Раствор, более богатый высокомолекулярным веществом, обычно выделяется в виде мельчайших капелек, которые уже затем могут образовывать сплошной слой.
Растворы высокомолекулярных соединений имеют значительную вязкость, которая быстро возрастает с увеличением концентрации растворов. Повышение концентрации макромолекулярных растворов, добавки веществ, понижающих растворимость полимера, изменение рН раствора и часто понижение температуры приводят к застудневанию, т. е. превращению сильно вязкого, но текучего раствора в сохраняющий форму студень. При образовании студней между макромолекулами полимера возникают молекулярные силы сцепления, приводящие к образованию пространственного сетчатого каркаса, ячейки которого заполнены жидким раствором. Образование студня можно рассматривать как начальную стадию коагуляции или как начало процесса разделения раствора ВМС на две фазы.
Студни преимущественно образуются высокополимерами с гибкими макромолекулами. Благодаря гибкости пространственной сетки студень при высушивании легко деформируется, сжимается, так что можно высушиванием получить совершенно сухой полимер, который сохраняет эластичность. Он снова способен набухать в подходящем растворителе. Процесс обратим и может быть повторен неоднократно.
В отличие от студней, гели — это двухфазные гетерогенные системы, образованные из высокополимеров с жесткими макромолекулами. Благодаря жесткости частиц и всего каркаса геля его объем при высушивании сокращается сравнительно немного. По мере удаления растворителя макромолекулы сближаются, но до известного предела из-за большой жесткости. Постепенно растворитель в ячейках заменяется воздухом, после чего остается пористая масса, которая пронизана тончайшими капиллярами и полостями, заполненными воздухом — твердая пена. После высушивания гели теряют способность вновь образовывать растворы, т.е. являются необратимыми системами.
Многие гели и студни под влиянием механических воздействий при перемешивании, встряхивании способны разжижаться, переходить в золи или растворы полимеров, а затем, при хранении в покое, опять застудневать. Подобное превращение может происходить несколько раз, оно протекает изотермически и называется тиксотропией.
При хранении гелей и студней, в системах происходят изменения, связанные с агрегацией частиц. В результате каркас студня постепенно сжимается в более плотную массу и отслаивается подвижная жидкая фаза. На поверхности студней вначале появляются отдельные капли жидкости, которые со временем превращаются в сплошную массу; сам же студень сокращается в объеме и становится менее эластичным. Такой процесс самопроизвольного расслаивания студней получил название синерезиса. Как правило, процесс этот необратим и свидетельствует о старении студня или геля.
Растворы высокомолекулярных электролитов. Высокомолекулярные электролиты или полиэлектролиты содержат ионогенные группы, по которым могут проходить процессы электролитической диссоциации. Белковые молекулы как продукты конденсации аминокислот содержат основные группы -NH2 и кислотные -СООН. Такие соединения называются амфолитами, т.е. они способны диссоциировать и по кислотному, и по основному типу в зависимости от рH среды. В водном растворе аминокислоты и белки находятся преимущественно в виде биполярных ионов (внутренних солей):
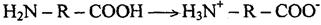
В кислой среде, когда в результате избытка водородных ионов подавлена ионизация карбоксильных групп, молекула белка ведет себя как основание, приобретая положительный заряд:
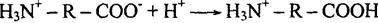
В щелочной среде, наоборот, подавлена ионизация аминогрупп, и молекула белка ведет себя как кислота:
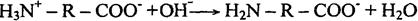
Однако при определенной величине рH степень диссоциации амино- и карбоксильных групп приобретает одинаковое значение, и тогда макромолекулы белка становятся электронейтральными. Подобное состояние белковой молекулы называют изоэлектрическим. В таком состоянии свойства белковых растворов резко меняются: уменьшается вязкость, снижается растворимость белка, изменяется даже форма макромолекул.
Значение рН отвечающее изоэлектрическому состоянию белков, называют изоэлектрической точкой (ИЭТ).
Устойчивость растворов ВМС. Все процессы нарушения устойчивости растворов ВМС связаны с переходом от полного к ограниченному растворению или не растворению ВМС при добавлении к ним других растворителей или электролитов. При этом снижается либо растворяющая способность растворителя, как в случае добавления ацетона к раствору каучука в бензоле, либо добавляемый электролит «оттягивает» на себя растворитель, как в случае высаливания водных растворов биополимеров.
Выделение ВМС из раствора наступает при добавлении к нему электролита, количество которого на 3 - 5 порядков превышает порог коагуляции, и не подчиняется правилу Шульце-Гарди. Процесс является обратимым. После удаления электролита из осадка диализом ВМС снова способно к растворению.
Под влиянием высокой и низкой температур, при действии концентрированных кислот и щелочей, лучистой энергии, ультразвука, механического воздействия, высокого давления в растворах белков происходит их специфическое необратимое осаждение, называемое денатурацией.
Электрофорез белков. Биологические макромолекулы — белки, нуклеиновые кислоты, полисахариды, являясь полиэлектролитами, находятся в растворе в виде заряженных частиц. Под действием электрического поля заряженные частицы перемещаются к катоду или аноду в зависимости от знака их суммарного заряда. Такое явление называется электрофорезом.
 2015-02-04
2015-02-04 4508
4508








